AMSPARITY 40 mg, solution injectable en seringue préremplie, boîte de 2 seringues préremplies de 0,80 mL
Dernière révision : 07/01/2025
Taux de TVA : 2.1%
Prix de vente : 422,32 €
Taux remboursement SS : 65%
Base remboursement SS : 422,32 €
Laboratoire exploitant : PFIZER
Polyarthrite rhumatoïde
Amsparity en association au méthotrexate est indiqué pour :
- le traitement de la polyarthrite rhumatoïde modéré à sévère, active chez les patients adultes lorsque la réponse aux traitements de fond antirhumatismaux, y compris le méthotrexate, est inadéquate.
- le traitement de la polyarthrite rhumatoïde sévère, active et évolutive chez les adultes non précédemment traités par le méthotrexate.
Amsparity peut être donné en monothérapie en cas d'intolérance au méthotrexate ou lorsque la poursuite du traitement par méthotrexate est inadaptée.
Il a été démontré qu'Amsparity ralentit la progression des dommages articulaires mesurés par radiographie et améliore les capacités fonctionnelles lorsqu'il est administré en association au méthotrexate.
Arthrite juvénile idiopathique
Arthrite juvénile idiopathique polyarticulaire
Amsparity en association au méthotrexate est indiqué pour le traitement de l'arthrite juvénile idiopathique polyarticulaire active chez les patients à partir de 2 ans en cas de réponse insuffisante à un ou plusieurs traitements de fond antirhumatismaux (DMARDs : Disease-Modifying Antirheumatic Drugs). Amsparity peut être administré en monothérapie en cas d'intolérance au méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est inadaptée (pour l'efficacité en monothérapie voir rubrique Propriétés pharmacodynamiques). L'adalimumab n'a pas été étudié chez les patients de moins de 2 ans.
Arthrite liée à l'enthésite
Amsparity est indiqué pour le traitement de l'arthrite active liée à l'enthésite chez les patients à partir de 6 ans en cas de réponse insuffisante ou d'intolérance au traitement conventionnel (voir rubrique Propriétés pharmacodynamiques).
Spondyloarthrite axiale
Spondylarthrite ankylosante (SA)
Amsparity est indiqué pour le traitement de la spondylarthrite ankylosante sévère et active chez les adultes ayant eu une réponse inadéquate au traitement conventionnel.
Spondyloarthrite axiale sans signes radiographiques de SA
Amsparity est indiqué dans le traitement de la spondyloarthrite axiale sévère sans signes radiographiques de SA, mais avec des signes objectifs d'inflammation à l'IRM et/ou un taux élevé de CRP chez les adultes ayant eu une réponse inadéquate ou une intolérance aux anti-inflammatoires non stéroïdiens (AINS).
Rhumatisme psoriasique
Amsparity est indiqué pour le traitement du rhumatisme psoriasique actif et évolutif chez les adultes lorsque la réponse à un traitement antérieur par antirhumatismal modificateur de la maladie a été inadéquate. Il a été démontré qu'Amsparity ralentit la progression des dommages articulaires périphériques tels que mesurés par radiographie, chez les patients ayant des formes polyarticulaires symétriques de la maladie (voir rubrique Propriétés pharmacodynamiques) et améliore les capacités fonctionnelles.
Psoriasis
Amsparity est indiqué dans le traitement du psoriasis en plaques, modéré à sévère, chez les patients adultes qui nécessitent un traitement systémique.
Psoriasis en plaques pédiatrique
Amsparity est indiqué dans le traitement du psoriasis en plaques chronique sévère chez les enfants à partir de 4 ans et les adolescents en cas de réponse insuffisante à un traitement topique et aux photothérapies ou lorsque ces traitements sont inappropriés.
Hidrosadénite suppurée
Amsparity est indiqué dans le traitement de l'hidrosadénite suppurée (HS) (maladie de Verneuil, acné inverse) active, modérée à sévère, chez les adultes et les adolescents à partir de 12 ans en cas de réponse insuffisante au traitement systémique conventionnel de l'HS (voir rubriques Propriétés pharmacodynamiques et Propriétés pharmacocinétiques).
Maladie de Crohn
Amsparity est indiqué dans le traitement de la maladie de Crohn active modérée à sévère, chez les patients adultes qui n'ont pas répondu malgré un traitement approprié et bien conduit par un corticoïde et/ou un immunosuppresseur, ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
Maladie de Crohn pédiatrique
Amsparity est indiqué dans le traitement de la maladie de Crohn active modérée à sévère, chez les enfants et les adolescents à partir de 6 ans, qui n'ont pas répondu à un traitement conventionnel comprenant un traitement nutritionnel de première intention et un corticoïde et/ou un immunomodulateur, ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
Rectocolite hémorragique
Amsparity est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère chez les patients adultes ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et la 6-mercaptopurine (6-MP) ou l'azathioprine (AZA), ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
Rectocolite hémorragique pédiatrique
Amsparity est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère chez les patients pédiatriques (à partir de 6 ans) ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et/ou la 6-mercaptopurine (6-MP) ou l'azathioprine (AZA), ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
Uvéite
Amsparity est indiqué dans le traitement de l'uvéite non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée.
Uvéite pédiatrique
Amsparity est indiqué dans le traitement de l'uvéite pédiatrique antérieure chronique non infectieuse chez les patients à partir de 2 ans en cas de réponse insuffisante ou d'intolérance au traitement conventionnel ou pour lesquels un traitement conventionnel est inapproprié.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Tuberculose active ou autres infections sévères telles que septicémie et infections opportunistes (voir rubrique Mises en garde spéciales et précautions d'emploi).
Insuffisance cardiaque modérée à sévère (NYHA classes III/IV) (voir rubrique Mises en garde spéciales et précautions d'emploi).
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, la dénomination et le numéro de lot du produit administré doivent être clairement enregistrés.
Infections
Les patients recevant des antagonistes du TNF sont plus prédisposés aux infections graves. Une fonction pulmonaire altérée peut augmenter le risque de développer des infections. Les patients doivent donc être surveillés étroitement afin de dépister des infections (y compris la tuberculose) avant, pendant et après le traitement par Amsparity. La durée d'élimination de l'adalimumab pouvant aller jusqu'à quatre mois, la surveillance devra être poursuivie pendant toute cette période.
Le traitement par Amsparity ne doit pas être instauré chez les patients présentant des infections actives, y compris les infections chroniques ou localisées, tant que les infections ne sont pas contrôlées. Chez les patients ayant été exposés à la tuberculose ou ayant voyagé dans des régions à haut risque de tuberculose ou de mycoses endémiques, telles que histoplasmose, coccidioïdomycose ou blastomycose, les risques et bénéfices du traitement par Amsparity doivent être pris en considération avant l'instauration du traitement (voir Autres infections opportunistes).
Les patients chez développent une nouvelle infection au cours du traitement par Amsparity doivent faire l'objet d'une surveillance soigneuse et un bilan diagnostique complet doit être pratiqué. Lorsqu'un patient développe une nouvelle infection grave ou une septicémie, l'administration d'Amsparity doit être interrompue et un traitement antimicrobien ou antifongique approprié doit être instauré jusqu'à ce que l'infection soit contrôlée. Le médecin doit faire preuve de prudence avant d'utiliser Amsparity chez des patients ayant des antécédents d'infection récidivante ou des conditions sous-jacentes susceptibles de les prédisposer aux infections, y compris un traitement concomitant par des médicaments immunosuppresseurs.
Infections graves
Des infections graves, incluant des septicémies dues à des infections bactériennes, mycobactériennes, fongiques invasives, parasitaires, virales ou à d'autres infections opportunistes, telles que listériose, légionellose et pneumocystose ont été rapportées chez des patients traités par adalimumab.
Les autres infections graves observées dans les essais cliniques sont : pneumonie, pyélonéphrite, arthrite septique et septicémie. Des cas d'infections nécessitant une hospitalisation ou ayant une issue fatale ont été rapportés.
Tuberculose
Des cas de tuberculose, incluant des cas de réactivation de la tuberculose et de primo-infection tuberculeuse, ont été rapportés pour des patients recevant l'adalimumab. Des cas de tuberculoses pulmonaire et extra-pulmonaire (c'est-à-dire disséminée) ont été rapportés.
Avant l'instauration du traitement par Amsparity, tous les patients doivent faire l'objet d'une recherche d'infection tuberculeuse active ou non (« latente »). Ce bilan doit comprendre une évaluation médicale détaillée chez les patients ayant des antécédents de tuberculose ou d'exposition antérieure possible à des patients atteints de tuberculose active et/ou d'un traitement immunosuppresseur actuel ou ancien. Des tests de dépistage appropriés (par exemple, test dermique à la tuberculine et radiographie pulmonaire) doivent être effectués chez tous les patients (conformément aux recommandations locales). Il est conseillé de noter la réalisation et les résultats de ces tests dans la carte de rappel patient. Il est rappelé aux prescripteurs que le test dermique à la tuberculine peut donner des résultats faux-négatifs notamment chez les patients gravement malades ou immunodéprimés.
En cas de diagnostic d'une tuberculose active, le traitement par Amsparity ne doit pas être instauré (voir rubrique Contre-indications).
Dans toutes les situations décrites ci-dessous, il convient d'évaluer très attentivement le rapport bénéfice/risque du traitement.
En cas de suspicion d'une tuberculose latente, la consultation d'un médecin, qualifié dans le traitement de la tuberculose, doit être envisagée.
En cas de diagnostic d'une tuberculose latente, une prophylaxie antituberculeuse appropriée et conforme aux recommandations locales doit être mise en œuvre avant le début du traitement par Amsparity.
Une prophylaxie antituberculeuse doit également être envisagée avant l'instauration d'Amsparity chez les patients ayant des facteurs de risque multiples ou significatifs de tuberculose malgré un test de dépistage de la tuberculose négatif et chez les patients ayant des antécédents de tuberculose latente ou active, chez qui l'administration d'un traitement anti-tuberculeux approprié ne peut être confirmée.
Des cas de réactivation d'une tuberculose malgré un traitement prophylactique sont survenus chez des patients traités par adalimumab. Certains patients qui avaient été traités avec succès pour une tuberculose active ont développé à nouveau la maladie pendant le traitement par adalimumab.
Les patients devront être informés qu'il leur faudra consulter leur médecin en cas de survenue de signes ou symptômes évocateurs d'une infection tuberculeuse (par exemple, toux persistante, amaigrissement/perte de poids, fébricule, apathie), pendant ou après le traitement par Amsparity.
Autres infections opportunistes
Des infections opportunistes, incluant des infections fongiques invasives, ont été observées chez des patients traités par adalimumab. Ces infections n'ont pas toujours été détectées chez les patients recevant des antagonistes du TNF, ce qui a retardé l'instauration d'un traitement approprié, avec parfois une issue fatale.
Chez les patients qui présentent des signes et symptômes tels que fièvre, malaise, perte de poids, sueurs, toux, dyspnée et/ou infiltrats pulmonaires ou une autre maladie systémique grave avec ou sans choc concomitant, une infection fongique invasive doit être suspectée ; dans ce cas, il convient d'arrêter immédiatement l'administration d'Amsparity. Le diagnostic et la mise en place d'un traitement antifongique empirique chez ces patients doivent être effectués en accord avec un médecin ayant l'expérience de la prise en charge des patients ayant des infections fongiques invasives.
Réactivation d'hépatite B
Une réactivation d'hépatite B s'est produite chez des patients qui ont reçu un antagoniste du TNF y compris l'adalimumab et qui étaient porteurs chroniques de ce virus (c'est-à-dire antigène de surface positif). Certains cas ont eu une issue fatale. Les patients doivent faire l'objet d'un dépistage d'infection à VHB avant l'initiation d'un traitement par Amsparity. Pour les patients pour lesquels le test de dépistage de l'hépatite B est positif, il est recommandé de consulter un médecin spécialisé dans le traitement de l'hépatite B.
Chez les porteurs du VHB qui nécessitent un traitement par Amsparity, il faut surveiller attentivement les signes et les symptômes d'infection active par le VHB tout au long du traitement et pendant plusieurs mois après son arrêt. Il n'y a pas de données disponibles suffisantes concernant le traitement de patients porteurs du VHB traités par antiviral associé à antagoniste du TNF pour prévenir une réactivation du VHB. Chez les patients qui développent une réactivation du VHB, Amsparity doit être arrêté et un traitement antiviral efficace ainsi qu'un traitement de support approprié doivent être initiés.
Événements neurologiques
Les antagonistes du TNF, dont l'adalimumab, ont été associés dans de rares circonstances à l'apparition ou à l'exacerbation des symptômes cliniques et/ou des signes radiographiques de maladie démyélinisante du système nerveux central y compris de sclérose en plaques, de névrite optique et de maladie démyélinisante périphérique, y compris syndrome de Guillain-Barré. La prudence est recommandée aux prescripteurs avant de traiter avec Amsparity les patients atteints d'une maladie démyélinisante du système nerveux central ou périphérique, préexistante ou de survenue récente ; l'arrêt du traitement par Amsparity doit être envisagé en cas d'apparition de l'un de ces affections. L'association entre l'uvéite intermédiaire et les maladies démyélinisantes du système nerveux central est connue. Une évaluation neurologique doit être réalisée chez les patients présentant une uvéite intermédiaire non infectieuse avant l'instauration du traitement par Amsparity, et répétée régulièrement au cours du traitement afin de rechercher toute maladie démyélinisante du système nerveux central préexistante ou évolutive.
Réactions allergiques
Au cours des essais cliniques, des réactions allergiques graves associées à l'adalimumab ont rarement été rapportées et des réactions allergiques non graves associées à l'adalimumab ont été peu fréquentes. Des cas de réactions allergiques graves, incluant de l'anaphylaxie ont été rapportés, après administration de l'adalimumab. En cas de survenue d'une réaction anaphylactique ou d'une autre réaction allergique grave, l'administration d'Amsparity doit être immédiatement interrompue et un traitement approprié mis en œuvre.
Immunosuppression
Au cours d'une étude portant sur 64 patients atteints de polyarthrite rhumatoïde et traités par adalimumab, on n'a enregistré aucun élément évocateur d'une dépression de l'hypersensibilité de type retardé, d'une diminution des taux d'immunoglobulines ou d'une modification de la numération des lymphocytes effecteurs T, B et NK, des monocytes/macrophages et des granulocytes neutrophiles.
Tumeurs malignes et troubles lymphoprolifératifs
Dans la partie contrôlée des essais cliniques avec des antagoniste du TNF, il a été observé plus de cas de tumeurs malignes, y compris des lymphomes, chez les patients traités par un antagoniste du TNF que chez les patients du groupe contrôle. Cependant, l'incidence a été rare. Au cours de la surveillance post-marketing, des cas de leucémie ont été rapportés chez des patients traités par antagoniste du TNF. De plus, il existe un contexte de risque accru de lymphome et de leucémie chez les patients atteints d'une polyarthrite rhumatoïde ancienne, et avec une activité inflammatoire importante, ce qui complique l'estimation du risque. Dans l'état actuel des connaissances, la possibilité d'un risque de développer des lymphomes, des leucémies ou d'autres tumeurs malignes chez les patients traités par antagoniste du TNF ne peut être exclue.
Des tumeurs malignes, dont certaines d'issue fatale, ont été rapportées après la commercialisation chez des enfants, des adolescents et des adultes jeunes (jusqu'à l'âge de 22 ans) traités par des antagonistes du TNF (initiation du traitement à ou avant l'âge de 18 ans), y compris l'adalimumab. La moitié de ces cas environ étaient des lymphomes. Les autres cas correspondaient à d'autres types de tumeurs malignes parmi lesquels des tumeurs malignes rares généralement associés à une immunosuppression. Le risque de développer des tumeurs malignes ne peut être exclu chez l'enfant et l'adolescent traités par des antagonistes du TNF.
Au cours de la surveillance post-marketing, de rares cas de lymphomes hépatospléniques à lymphocytes T ont été identifiés chez des patients traités par adalimumab. Cette forme rare de lymphome à lymphocytes T a une évolution pathologique très agressive et est souvent fatale. Certains de ces lymphomes hépatospléniques à lymphocytes T observés avec l'adalimumab sont survenus chez des adultes jeunes ayant un traitement concomitant par azathioprine ou par 6-mercaptopurine utilisé dans les maladies inflammatoires de l'intestin. Le risque potentiel de l'association de l'azathioprine ou de la 6-mercaptopurine avec l'adalimumab doit être soigneusement pris en considération. Un risque de développement de lymphome hépatosplénique à lymphocytes T chez des patients traités par Amsparity ne peut pas être exclu (voir rubrique Effets indésirables).
Il n'existe pas d'études chez des patients avec antécédents de tumeurs malignes ou chez lesquels le traitement par adalimumab est poursuivi après le développement d'une tumeur maligne. En conséquence, une prudence accrue devra être observée lorsqu'on envisage un traitement de ces patients par adalimumab (voir rubrique Effets indésirables).
Tous les patients, notamment ceux ayant des antécédents de traitement immunosuppresseur intense ou atteints de psoriasis et ayant des antécédents de puvathérapie, devront être examinés à la recherche d'un cancer cutané autre que mélanome avant et pendant le traitement par Amsparity. Des cas de mélanome et de carcinome à cellules de Merkel ont été également rapportés chez les patients traités par antagonistes du TNF, y compris l'adalimumab (voir rubrique Effets indésirables).
Dans une étude clinique prospective évaluant l'emploi d'un autre antagoniste du TNF, l'infliximab, chez des patients atteints de broncho-pneumopathie chronique obstructive (BPCO), modérée à sévère, on rapporte plus de cancers, surtout du poumon, de la tête et du cou, parmi les patients traités par infliximab comparativement aux patients du groupe contrôle. Tous les patients avaient des antécédents de tabagisme important. Pour cette raison, des précautions doivent être prises dans l'emploi d'un antagoniste du TNF chez des patients atteints de BPCO, et aussi chez des patients à risque de cancer à cause d'un tabagisme important.
Sur la base des données actuelles, on ne sait pas si le traitement par adalimumab influence le risque de développer une dysplasie ou un cancer du côlon. Tous les patients atteints de rectocolite hémorragique qui présentent un risque élevé de dysplasie ou de cancer du côlon (par exemple, les patients atteints de rectocolite hémorragique ancienne ou de cholangite sclérosante primitive) ou qui ont un antécédent de dysplasie ou de cancer du côlon doivent faire l'objet d'un dépistage régulier à la recherche d'une dysplasie avant le traitement et pendant toute l'évolution de leur maladie. Cette évaluation doit inclure une coloscopie et des biopsies conformément aux recommandations locales.
Réactions hématologiques
De rares cas de pancytopénie, y compris d'anémie aplasique, ont été rapportés avec les antagonistes du
TNF. Des événements indésirables du système hématologique comprenant des cytopénies médicalement significatives (par exemple, thrombocytopénie, leucopénie) ont été observés avec l'adalimumab. Il doit être conseillé à tous les patients de demander immédiatement un avis médical s'ils développent des signes ou des symptômes suggérant des dyscrasies sanguines (par exemple, fièvre persistante, ecchymoses, saignements, pâleur) sous Amsparity. L'arrêt du traitement par Amsparity devra être envisagé chez les patients ayant des anomalies hématologiques significatives seront confirmées.
Vaccinations
Des réponses anticorps similaires au vaccin pneumococcique 23-valent standard et à la vaccination contre le virus trivalent de la grippe ont été observées dans une étude chez 226 adultes atteints de polyarthrite rhumatoïde traités par adalimumab ou placebo. Il n'y a pas de données disponibles sur la transmission secondaire d'infection par des vaccins vivants chez les patients recevant l'adalimumab.
Chez les enfants et les adolescents, il est recommandé, si possible, que toutes les vaccinations soient à jour conformément aux recommandations vaccinales en vigueur avant l'instauration du traitement par adalimumab.
Les patients sous adalimumab peuvent recevoir simultanément des vaccins, à l'exception des vaccins vivants. L'administration de vaccins vivants (par exemple, vaccin BCG) à des nourrissons qui ont été exposés à l'adalimumab in utero n'est pas recommandée pendant les 5 mois suivant la dernière injection d'adalimumab chez la mère pendant la grossesse.
Insuffisance cardiaque congestive
Dans un essai clinique mené avec un autre antagoniste duTNF, on a observé une aggravation de l'insuffisance cardiaque congestive et une augmentation de la mortalité par insuffisance cardiaque congestive. Des cas d'aggravation d'insuffisance cardiaque congestive ont aussi été rapportés chez des patients sous adalimumab. Amsparity doit être utilisé avec prudence chez les patients atteints d'insuffisance cardiaque légère (NYHA classes I/II). Amsparity est contre-indiqué dans l'insuffisance cardiaque modérée à sévère (voir rubrique Contre-indications). Le traitement par Amsparity doit être arrêté chez les patients présentant de nouveaux symptômes ou une aggravation de leurs symptômes d'insuffisance cardiaque congestive.
Processus auto-immuns
Le traitement par Amsparity peut entraîner la formation d'anticorps auto-immuns. L'impact d'un traitement à long terme par adalimumab sur le développement de maladies auto-immunes est inconnu. Si un patient développe des symptômes suggérant un syndrome de type lupus à la suite d'un traitement par Amsparity et présente une réaction positive aux anticorps anti-ADN double brin, le traitement par Amsparity ne devra pas être poursuivi (voir rubrique Effets indésirables).
Administration simultanée de traitements de fond (DMARDs) biologiques ou antagonistes du TNF
Des infections graves ont été observées dans des études cliniques lors de l'administration simultanée d'anakinra et d'un autre antagoniste du TNF, l'étanercept, sans bénéfice clinique supplémentaire comparé à l'étanercept seul. En raison de la nature des événements indésirables observés avec le traitement par l'association étanercept et anakinra, des effets néfastes similaires peuvent aussi résulter de l'association d'anakinra et d'autres antagonistes du TNF. Par conséquent, l'association d'adalimumab et d'anakinra n'est pas recommandée (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
L'administration concomitante d'adalimumab avec d'autres DMARDs (par exemple, anakinra et abatacept) ou avec d'autres antagonistes du TNF n'est pas recommandée en raison de l'augmentation possible du risque d'infections, y compris d'infections graves, et d'autres interactions pharmacologiques potentielles (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Chirurgie
L'expérience concernant la tolérance au cours d'interventions chirurgicales chez les patients traités par adalimumab est limitée. La longue demi-vie de l'adalimumab doit être prise en compte si une intervention chirurgicale est prévue. Un patient traité par Amsparity nécessitant une intervention chirurgicale doit être attentivement surveillé afin de dépister des infections et des actions appropriées doivent être entreprises. L'expérience concernant la tolérance de l'adalimumab chez les patients opérés pour arthroplastie est limitée.
Occlusion du grêle
Dans la maladie de Crohn, l'échec au traitement peut indiquer la présence de sténoses fibreuses fixes pouvant nécessiter un traitement chirurgical. Les données disponibles suggèrent que l'adalimumab n'aggrave pas ou ne provoque pas de sténoses.
Sujets âgés
La fréquence des infections graves chez les sujets traités par adalimumab âgés de plus de 65 ans (3,7 %) est plus élevée que chez les patients de moins de 65 ans (1,5 %). Certains cas ont eu une issue fatale. Une attention particulière concernant le risque d'infection doit être apportée lors du traitement des sujets âgés.
Population pédiatrique
Voir vaccinations ci-dessus.
Excipients à effet notoire
Polysorbate
Ce médicament contient du polysorbate 80. Amsparity 40 mg, solution injectable contient 0,16 mg de polysorbate 80 par seringue préremplie unidose et par stylo prérempli unidose de 0,8 ml, équivalant à 0,2 mg/ml de polysorbate 80. Le polysorbate 80 peut provoquer des réactions d'hypersensibilité.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose de 0,8 ml, c.-à-d. qu'il est essentiellement « sans sodium ».
Résumé du profil de tolérance
L'adalimumab a été étudié chez 9 506 patients dans des essais pivots contrôlés et en ouvert d'une durée de 60 mois et plus. Ces essais ont inclus des patients atteints de polyarthrite rhumatoïde récente ou ancienne, d'arthrite juvénile idiopathique (arthrite juvénile idiopathique polyarticulaire et arthrite liée à l'enthésite) et des patients atteints de spondyloarthrite axiale (spondylarthrite ankylosante et spondyloarthrite axiale sans signes radiographiques de SA), de rhumatisme psoriasique, de la maladie de Crohn, de rectocolite hémorragique, de psoriasis, d'hidrosadénite suppurée et d'uvéite. Les études pivots contrôlées portaient sur 6 089 patients ayant reçu l'adalimumab et 3 801 patients ayant reçu un placebo ou un comparateur actif pendant la phase contrôlée.
Le pourcentage de patients ayant interrompu le traitement en raison d'événements indésirables pendant la phase en double aveugle, contrôlée, des études pivots a été de 5,9 % chez les patients traités par adalimumab et de 5,4 % chez les patients du groupe contrôle.
Les effets indésirables les plus fréquemment rapportés sont les infections (telles que les rhinopharyngites, les infections des voies respiratoires hautes et les sinusites), les réactions au site d'injection (érythème, démangeaisons, hémorragie, douleur ou gonflement), les céphalées et les douleurs musculo-squelettiques.
Des effets indésirables graves ont été rapportés avec l'adalimumab. Les antagonistes du TNF, tels que l'adalimumab affectent le système immunitaire et leur utilisation peut avoir des répercussions sur les défenses du corps contre les infections et le cancer.
Des infections menaçant le pronostic vital et d'issue fatale (comprenant septicémie, infections opportunistes et tuberculose), des réactivations du VHB et différents cancers (y compris leucémie, lymphome et lymphome hépatosplénique à lymphocytes T) ont également été rapportés avec l'utilisation de l'adalimumab.
Des réactions hématologiques, neurologiques et auto-immuns sévères ont également été rapportés. Ceci comprend de rares cas de pancytopénie, d'anémie médullaire, des événements de démyélinisation centrale et périphérique et des cas de lupus, d'affections liées au lupus et de syndrome de Stevens-Johnson.
Population pédiatrique
En général, la fréquence et le type des événements indésirables observés chez l'enfant et l'adolescent ont été comparables à ceux observés chez les patients adultes.
Liste tabulée des effets indésirables
La liste suivante des effets indésirables est basée sur les études cliniques et sur l'expérience après commercialisation et est présentée par classe de systèmes d'organes et par fréquence dans le tableau 7 ci-dessous : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité. La fréquence la plus élevée observée dans les diverses indications a été incluse. La présence d'un astérisque (*) dans la colonne « Classe de systèmes d'organes » indique que de plus amples informations sont disponibles aux rubriques Contre-indications, Mises en garde spéciales et précautions d'emploi et Effets indésirables.
Tableau 7. Effets indésirables
|
Classe de systèmes d'organes |
Fréquence |
Effet indésirable |
|
Infections et infestations* |
Très fréquent |
Infections des voies respiratoires (y compris infection des voies respiratoires basses et infection des voies respiratoires hautes, pneumonie, sinusite, pharyngite, rhino-pharyngite et pneumonie herpétique virale) |
|
Fréquent |
Infections systémiques (y compris septicémie, candidose et grippe), infections intestinales (y compris gastro-entérite virale), infections cutanées et des tissus mous (y compris panaris superficiel périunguéal, cellulite, impétigo, fasciite nécrosante et zona), infections de l'oreille, infections buccales (y compris herpès simplex, herpès buccal et infections dentaires), infections des organes de reproduction (y compris mycose vulvo-vaginale), infections des voies urinaires (y compris pyélonéphrite), infections fongiques, infections articulaires |
|
|
Peu fréquent |
Infections neurologiques (y compris méningite virale), infections opportunistes et tuberculose (y compris coccidioïdomycose, histoplasmose et infections à Mycobacterium avium complex), infections bactériennes, infections oculaires, diverticulite1 |
|
|
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes)* |
Fréquent |
Cancer de la peau à l'exclusion du mélanome (y compris carcinome basocellulaire et carcinome malpighien spino-cellulaire), tumeur bénigne |
|
Peu fréquent |
Lymphome**, tumeurs des organes solides (y compris cancer du sein, du poumon et de la thyroïde), mélanome** |
|
|
Rare |
Leucémie1 |
|
|
Fréquence indéterminée |
Lymphome hépatosplénique à lymphocytes T1, carcinome à cellules de Merkel (carcinome neuroendocrine cutané)1, sarcome de Kaposi |
|
|
Affections hématologiques et du système lymphatique* |
Très fréquent |
Leucopénie (y compris neutropénie et agranulocytose), anémie |
|
Fréquent |
Leucocytose, thrombocytopénie |
|
|
Peu fréquent |
Purpura thrombopénique idiopathique |
|
|
Rare |
Pancytopénie |
|
|
Affections du système immunitaire* |
Fréquent |
Hypersensibilité, allergies (y compris allergie saisonnière) |
|
|
Peu fréquent |
Sarcoïdose1, vascularite |
|
Rare |
Anaphylaxie1 |
|
|
Troubles du métabolisme et de la nutrition |
Très fréquent |
Lipides augmentés |
|
Fréquent |
Hypokaliémie, acide urique augmenté, sodium sanguin anormal, hypocalcémie, hyperglycémie, hypophosphatémie, déshydratation |
|
|
Affections psychiatriques |
Fréquent |
Troubles de l'humeur (y compris dépression), anxiété, insomnie |
|
Affections du système nerveux* |
Très fréquent |
Céphalées |
|
Fréquent |
Paresthésies (y compris hypoesthésie), migraine, compression des racines nerveuses |
|
|
Peu fréquent |
Accident cérébrovasculaire1, tremblements, neuropathie |
|
|
Rare |
Sclérose en plaques, affections démyélinisantes (par ex. névrite optique, syndrome de Guillain-Barré)1 |
|
|
Affections oculaires |
Fréquent |
Troubles visuels, conjonctivite, blépharite, gonflement des yeux |
|
Peu fréquent |
Diplopie |
|
|
Affections de l'oreille et du labyrinthe |
Fréquent |
Vertiges |
|
Peu fréquent |
Surdité, acouphènes |
|
|
Affections cardiaques* |
Fréquent |
Tachycardie |
|
Peu fréquent |
Infarctus du myocarde1, arythmie, insuffisance cardiaque congestive |
|
|
Rare |
Arrêt cardiaque |
|
|
Affections vasculaires |
Fréquent |
Hypertension, bouffées de chaleur, hématomes |
|
Peu fréquent |
Anévrysme de l'aorte, occlusion vasculaire, thrombophlébite |
|
|
Affections respiratoires, thoraciques et médiastinales* |
Fréquent |
Asthme, dyspnée, toux |
|
Peu fréquent |
Embolie pulmonaire1, pneumopathie interstitielle diffuse, broncho-pneumopathie chronique obstructive, pneumopathie, épanchement pleural1 |
|
|
Rare |
Fibrose pulmonaire1 |
|
|
Affections gastrointestinales |
Très fréquent |
Douleurs abdominales, nausées et vomissements |
|
|
Fréquent |
Hémorragie gastro-intestinale, dyspepsie, reflux gastro-œsophagien, syndrome de Gougerot-Sjögren |
|
Peu fréquent |
Pancréatite, dysphagie, œdème du visage |
|
|
Rare |
Perforation intestinale1 |
|
|
Affections hépatobiliaires* |
Très fréquent |
Élévation des enzymes hépatiques |
|
Peu fréquent |
Cholécystite et lithiase biliaire, stéatose hépatique, hyperbilirubinémie |
|
|
Rare |
Hépatite, réactivation du virus de l'hépatite B1, hépatite auto-immune1 |
|
|
Fréquence indéterminée |
Insuffisance hépatique1 |
|
|
Affections de la peau et du tissu sous-cutané |
Très fréquent |
Rash (y compris éruption exfoliative) |
|
Fréquent |
Aggravation ou apparition d'un psoriasis (y compris psoriasis pustulaire palmoplantaire)1, urticaire, ecchymoses (y compris purpura), dermatite (y compris eczéma), onychoclasie, hyperhidrose, alopécie1, prurit |
|
|
Peu fréquent |
Sueurs nocturnes, cicatrice |
|
|
Rare |
Érythème polymorphe1, syndrome de Stevens-Johnson1, angiœdème1, vascularite cutanée1, réaction lichénoïde cutanée1 |
|
|
Fréquence indéterminée |
Aggravation des symptômes de dermatomyosite1 |
|
|
Affections musculosquelettiques et systémiques |
Très fréquent |
Douleurs musculo-squelettiques |
|
Fréquent |
Spasmes musculaires (y compris augmentation de la créatine phosphokinase sérique) |
|
|
Peu fréquent |
Rhabdomyolyse, lupus érythémateux disséminé |
|
|
Rare |
Syndrome de type lupus1 |
|
|
Affections du rein et des voies urinaires |
Fréquent |
Insuffisance rénale, hématurie |
|
Peu fréquent |
Nycturie |
|
|
Affections des organes de reproduction et du sein |
Peu fréquent |
Troubles de la fonction érectile |
|
Troubles généraux et anomalies au site d'administration* |
Très fréquent |
Réaction au site d'injection (y compris érythème au site d'injection) |
|
Fréquent |
Douleur thoracique, œdème, fièvre1 |
|
|
Peu fréquent |
Inflammation |
|
|
Investigations* |
Fréquent |
Troubles de la coagulation et troubles hémorragiques (incluant un allongement du temps de céphaline activé), positivité aux auto-anticorps (y compris aux anticorps anti-ADN double brin), lactate déshydrogénase sanguine augmentée |
|
Fréquence indéterminée |
Augmentation du poids2 |
|
|
Lésions, intoxications et complications liées aux procédures |
Fréquent |
Mauvaise cicatrisation |
* De plus amples informations sont disponibles aux rubriques Contre-indications, Mises en garde spéciales et précautions d'emploi et Effets indésirables.
** y compris les études d'extension en ouvert
1 comprenant les données des notifications spontanées
2 Le changement de poids moyen par rapport aux valeurs initiales pour l'adalimumab allait de 0,3 kg à 1,0 kg pour toutes les indications chez l'adulte, contre (moins) -0,4 kg à 0,4 kg pour le placebo, sur une période de traitement de 4 à 6 mois. Une augmentation de poids comprise entre 5 et 6 kg a également été observée au cours d'études d'extension à long terme, avec des expositions moyennes d'environ 1 à 2 ans sans groupe témoin, en particulier chez les patients atteints de la maladie de Crohn et de colite ulcéreuse. Le mécanisme qui sous-tend cet effet n'est pas clair mais pourrait être associé à l'action anti-inflammatoire de l'adalimumab.
Hidrosadénite suppurée
Le profil de tolérance chez les patients atteints d'HS traités par adalimumab de façon hebdomadaire correspond au profil de sécurité tolérance connu de l'adalimumab.
Uvéite
Le profil de tolérance chez les patients atteints d'uvéite traités par adalimumab toutes les deux semaines correspond au profil de tolérance connu de l'adalimumab.
Description des effets indésirables sélectionnés
Réactions au point d'injection
Dans les essais pivots contrôlés menés chez l'adulte et l'enfant, 12,9 % des patients traités par adalimumab ont présenté des réactions au point d'injection (érythème et/ou prurit, saignement, douleur ou tuméfaction) contre 7,2 % des patients recevant le placebo ou le comparateur actif. Les réactions au point d'injection n'ont généralement pas nécessité l'arrêt du médicament.
Infections
Dans les essais pivots contrôlés menés chez l'adulte et l'enfant, la fréquence des infections a été de 1,51 par patient-année dans le groupe adalimumab et de 1,46 par patient-année dans le groupe placebo et le groupe contrôle. Les infections consistaient essentiellement en rhinopharyngites, infections de l'appareil respiratoire supérieur et sinusites. La plupart des patients ont continué l'adalimumab après la guérison de l'infection.
L'incidence des infections graves a été de 0,04 par patient-année dans le groupe adalimumab et de 0,03 par patient-année dans le groupe placebo et le groupe contrôle.
Dans les études contrôlées et en ouvert avec l'adalimumab menées chez l'adulte et dans la population pédiatrique, des infections graves (y compris des infections d'issue fatale, ce qui s'est produit rarement) ont été rapportées dont des signalements de tuberculose (y compris miliaire et à localisations extra-pulmonaires) et d'infections opportunistes invasives (par exemple, histoplasmose disséminée ou histoplasmose extrapulmonaire, blastomycose, coccidioïdomycose, pneumocystose, candidose, aspergillose et listériose). La plupart des cas de tuberculose sont survenus dans les huit premiers mois après le début du traitement et peuvent être le reflet d'une réactivation d'une maladie latente.
Tumeurs malignes et troubles lymphoprolifératifs
Aucun cas de cancer n'a été observé chez 249 patients pédiatriques représentant une exposition de 655,6 patients-année lors des essais avec l'adalimumab chez les patients atteints d'arthrite juvénile idiopathique (arthrite juvénile idiopathique polyarticulaire et arthrite liée à l'enthésite). De plus, aucun cas de cancer n'a été observé chez 192 patients pédiatriques représentant une exposition de 498,1 patients-année lors des essais avec l'adalimumab chez les patients atteints de la maladie de Crohn pédiatrique. Aucun cas de cancer n'a été observé chez 77 patients pédiatriques représentant une exposition de 80,0 patients-année lors d'un essai avec l'adalimumab chez les patients atteints de psoriasis en plaques chronique pédiatrique. Lors d'une étude avec l'adalimumab menée chez des patients pédiatriques atteints de rectocolite hémorragiques, aucun cas de cancer n'a été observé chez 93 patients pédiatriques représentant une exposition de 65,3 patients-années. Aucun cas de cancer n'a été observé chez 60 patients pédiatriques représentant une exposition de 58,4 patients-année lors d'une étude avec l'adalimumab chez les patients atteints d'uvéite pédiatrique.
Pendant les périodes contrôlées des essais pivots chez l'adulte avec l'adalimumab d'une durée d'au moins 12 semaines chez des patients atteints de polyarthrite rhumatoïde active modérée à sévère, de spondylarthrite ankylosante, de spondyloarthrite axiale sans signes radiographiques de SA, de rhumatisme psoriasique, de psoriasis, d'hidrosadénite suppurée, de la maladie de Crohn, de rectocolite hémorragique et d'uvéite, un taux (intervalle de confiance à 95 %) de cancers autres que lymphomes ou cancers de la peau non mélanomes, de 6,8 (4,4 - 10,5) pour 1 000 patients-année parmi les 5 291 patients traités par adalimumab, a été observé versus un taux de 6,3 (3,4 - 11,8) pour 1 000 patients-année parmi les 3 444 patients du groupe contrôle (la durée moyenne du traitement était de 4,0 mois pour les patients traités par adalimumab et de 3,8 mois pour les patients du groupe contrôle). Le taux (intervalle de confiance à 95 %) de cancers de la peau non mélanomes était de 8,8 (6,0 - 13,0) pour 1 000 patients-année parmi les patients traités par adalimumab et de 3,2 (1,3 - 7,6) pour 1 000 patients-année parmi les patients du groupe contrôle. Dans ces cancers de la peau, des carcinomes spino-cellulaires sont survenus à des taux (intervalle de confiance à 95 %) de 2,7 (1,4 - 5,4) pour 1 000 patients-année parmi les patients traités par adalimumab et 0,6 (0,1 - 4,5) pour 1 000 patients-année parmi les patients du groupe contrôle. Le taux (intervalle de confiance à 95 %) de lymphomes était de 0,7 (0,2 - 2,7) pour 1 000 patients-année parmi les patients traités par adalimumab et 0,6 (0,1 - 4,5) pour 1 000 patients-année parmi les patients du groupe contrôle.
En joignant les périodes contrôlées de ces essais et les études d'extension en ouvert terminées ou en cours avec une durée moyenne d'environ 3,3 ans incluant 6 427 patients et plus de 26 439 patients-année de traitement, le taux observé de cancers, autres que lymphomes et cancers de la peau non mélanomes est d'environ 8,5 pour 1 000 patients-année. Le taux observé de cancers de la peau non-mélanomes est d'environ 9,6 pour 1 000 patients-année et le taux de lymphomes observés est d'environ 1,3 pour 1 000 patients-année.
Après la mise sur le marché de janvier 2003 à décembre 2010, essentiellement chez les patients atteints de polyarthrite rhumatoïde, le taux spontanément rapporté de cancers est approximativement de 2,7 pour 1 000 patients-année de traitement. Les taux spontanément rapportés pour les cancers de la peau non-mélanomes et les lymphomes sont respectivement d'environ 0,2 et 0,3 pour 1 000 patientsannée de traitement (voir rubrique Mises en garde spéciales et précautions d'emploi).
Après la mise sur le marché, de rares cas de lymphome hépatosplénique à lymphocytes T ont été rapportés chez des patients traités par adalimumab (voir rubrique Mises en garde spéciales et précautions d'emploi).
Auto-anticorps
Des recherches d'auto-anticorps répétées ont été effectuées sur des échantillons de sérum des patients des essais I-V dans la polyarthrite rhumatoïde. Dans ces essais, les titres d'anticorps antinucléaires initialement négatifs étaient positifs à la semaine 24 chez 11,9 % des patients traités par adalimumab et 8,1 % des patients sous placebo et comparateur. Deux patients sur les 3 441 traités par adalimumab dans toutes les études dans la polyarthrite rhumatoïde et le rhumatisme psoriasique ont présenté des signes cliniques évoquant un syndrome pseudo-lupique d'apparition nouvelle. L'état des patients s'est amélioré après l'arrêt du traitement. Aucun patient n'a présenté de néphrite lupique ou de symptômes du système nerveux central.
Événements hépatobiliaires
Dans les essais contrôlés de phase III chez les patients de polyarthrite rhumatoïde et le rhumatisme psoriasique avec une période de contrôle de 4 à 104 semaines, des élévations d'ALAT ≥ 3 x LSN sont survenues chez 3,7 % des patients traités par adalimumab et chez 1,6 % des patients du groupe contrôle.
Dans les essais contrôlés de phase III de l'adalimumab chez les patients atteints d'arthrite juvénile idiopathique polyarticulaire âgés de 4 à 17 ans et les patients atteints d'arthrite liée à l'enthésite âgés de 6 à 17 ans, des élévations d'ALAT ≥ 3 x LSN sont survenues chez 6,1 % des patients traités par adalimumab et chez 1,3 % des patients du groupe contrôle. La plupart des élévations d'ALAT sont survenues dans le cadre d'une utilisation concomitante de méthotrexate. Aucune élévation d'ALAT ≥ 3 x LSN n'est survenue au cours de l'essai de phase III de l'adalimumab chez des patients atteints d'arthrite juvénile idiopathique polyarticulaire âgés de 2 à < 4 ans.
Dans les essais contrôlés de phase III d'adalimumab chez les patients atteints de maladie de Crohn et de rectocolite hémorragique avec une période de contrôle de 4 à 52 semaines, des élévations d'ALAT ≥ 3 x LSN sont survenues chez 0,9 % des patients traités par adalimumab et chez 0,9 % des patients du groupe contrôle.
Dans l'essai de phase III de l'adalimumab chez les enfants et adolescents atteints de maladie de Crohn qui a évalué l'efficacité et le profil de tolérance de deux schémas posologiques d'entretien en fonction du poids corporel après un traitement d'induction ajusté au poids corporel jusqu'à 52 semaines de traitement, des élévations d'ALAT ≥ 3 x LSN sont survenues chez 2,6 % des patients (5/192), parmi lesquels 4 étaient traités en association avec des immunosuppresseurs à l'inclusion.
Dans les essais contrôlés de phase III dans le psoriasis en plaques avec une période de contrôle de 12 à 24 semaines, des élévations d'ALAT ≥ 3 x LSN sont survenues chez 1,8 % des patients traités par adalimumab et chez 1,8 % des patients du groupe contrôle.
Il n'a pas été observé d'élévations de l'ALAT ≥ 3 x LSN dans l'essai de phase III d'adalimumab chez des patients pédiatriques atteints de psoriasis en plaques.
Dans les essais cliniques contrôlés de l'adalimumab (doses initiales de 160 mg à la semaine 0 et 80 mg à la semaine 2 suivies de 40 mg chaque semaine à partir de la semaine 4), chez les patients atteints d'hidrosadénite suppurée avec une période de contrôle de 12 à 16 semaines, des élévations d'ALAT ≥ 3 x LSN sont survenues chez 0,3 % des patients traités par adalimumab et 0,6 % des patients du groupe contrôle.
Dans les essais contrôlés de l'adalimumab (dose initiale de 80 mg à la semaine 0 suivie de 40 mg toutes les deux semaines à partir de la semaine 1) chez les patients adultes atteints d'uvéite pour une durée allant jusqu'à 80 semaines, avec une durée médiane d'exposition de respectivement 166,5 jours et 105,0 jours pour les patients traités par adalimumab et les patients du groupe contrôle, des élévations d'ALAT ≥ 3 x LSN sont survenues chez 2,4 % des patients traités par adalimumab et 2,4 % des patients du groupe contrôle.
Dans l'essai clinique contrôlé de phase III de l'adalimumab mené chez des patients atteints de rectocolite hémorragique pédiatrique (N = 93) qui a évalué l'efficacité et la sécurité d'une dose d'entretien de 0,6 mg/kg (dose maximale de 40 mg) administrée une semaine sur deux (N = 31) et d'une dose d'entretien de 0,6 mg/kg (dose maximale de 40 mg) administrée chaque semaine (N = 32), à la suite d'une dose d'induction ajustée en fonction du poids corporel de 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0 et à la semaine 1, et de 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2 (N = 63), ou d'une dose d'induction de 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0, d'un placebo à la semaine 1, et d'une dose de 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2 (N = 30), des élévations de l'ALAT ≥ 3 x LSN sont survenues chez 1,1 % (1/93) des patients.
Dans les essais, toutes indications confondues, les patients avec ALAT augmentées étaient asymptomatiques et dans la plupart des cas les élévations étaient transitoires et réversibles lors de la poursuite du traitement. Cependant, après la mise sur le marché, des insuffisances hépatiques ainsi que des affections hépatiques moins sévères, qui peuvent précéder une insuffisance hépatique, tels que des hépatites y compris des hépatites auto-immunes, ont été rapportées chez des patients recevant de l'adalimumab.
Administration concomitante d'azathioprine/6-mercaptopurine
Lors d'études dans la maladie de Crohn chez l'adulte, une incidence plus élevée d'événements indésirables tumoraux et liés à des infections graves a été observée avec l'association adalimumab et azathioprine/6-mercaptopurine comparativement à l'adalimumab utilisé seul.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
AVANT L'INSTAURATION DU TRAITEMENT,
• Rechercher une INFECTION TUBERCULEUSE active ou non
(latente). Ce bilan doit comprendre :
- un interrogatoire médical complet, une recherche des antécédents personnels
de tuberculose ou d'exposition antérieure possible à des patients atteints de
tuberculose active et/ou d'un traitement immunosuppresseur actuel ou ancien,
- des tests de dépistage appropriés, par exemple test dermique à la tuberculine
et radiographie pulmonaire. Il est conseillé de noter la réalisation de ces
tests dans la carte de surveillance du patient. Il est rappelé aux
prescripteurs que le test dermique à la tuberculine peut donner des
faux-négatifs notamment chez les patients gravement malades ou immunodéprimés.
• Envisager une PROPHYLAXIE ANTITUBERCULEUSE chez les patients ayant
des facteurs de risque multiples ou significatifs de tuberculose malgré un test
de dépistage de la tuberculose négatif et chez les patients ayant des antécédents
de tuberculose latente ou active, chez qui l'administration d'un traitement
antituberculeux approprié ne peut être confirmée.
• Evaluer les risques et bénéfices du traitement
chez les patients ayant été exposés à la tuberculose ou ayant voyagé dans des régions
à haut risque de tuberculose ou de mycoses endémiques, telles qu'histoplasmose,
coccidioïdomycose ou blastomycose.
SURVEILLER tout signe d'infection avant, pendant et jusqu'à 4 mois après
l'arrêt du traitement.
SUSPECTER UNE INFECTION FONGIQUE INVASIVE chez les patients qui présentent des
signes et symptômes tels que fièvre, malaise, perte de poids, sueurs, toux,
dyspnée et/ou infiltrats pulmonaires ou une autre maladie systémique grave avec
ou sans choc concomitant. Dans un tel cas, il convient d'arrêter immédiatement
l'administration du traitement.
Les patients à risque d' INFECTION PAR LE VHB doivent faire l'objet d'un
dépistage préalable d'infection à VHB avant l'initiation d'un traitement.
Chez les porteurs du VHB qui nécessitent un traitement par ce médicament, il
faut surveiller attentivement les signes et les symptômes d'infection active
par le VHB tout au long du traitement et pendant plusieurs mois après son
arrêt.
AVANT ET PENDANT LE TRAITEMENT :
• tous les patients, notamment ceux ayant des antécédents de
traitement immunosuppresseur intense ou atteints de psoriasis et ayant des
antécédents de puvathérapie, devront être examinés à la recherche d'un cancer
cutané autre que mélanome.
• une évaluation neurologique doit être réalisée chez les
patients présentant une uvéite intermédiaire non infectieuse avant
l'instauration du traitement, et répétée régulièrement au cours du traitement
afin de rechercher toute maladie démyélinisante du système nerveux central
préexistante ou évolutive.
VACCINATIONS : chez les enfants et les adolescents, il est recommandé, si
possible, que toutes les vaccinations soient à jour conformément aux
recommandations vaccinales en vigueur avant l'instauration du traitement par
l'adalimumab.
Les nourrissons de mère traitée pendant la grossesse ont un risque accru
d'infections. L'administration de vaccins vivants (comme le vaccin BCG par
exemple) à des enfants exposés in utéro n'est pas recommandée pendant les 5
mois suivant la dernière injection de la mère durant la grossesse
PREVENIR IMMEDIATEMENT LE MEDECIN en cas de :
- Eruption cutanée sévère, urticaire, ou signes de réactions allergiques.
- Gonflement de la face, des mains, des pieds.
- Gêne respiratoire, gêne en avalant.
- Essoufflement à l'effort ou en position allongée ou gonflement des pieds.
- Symptômes de tuberculose (toux persistante, perte de poids, apathie, fièvre).
- Signes et symptômes évocateurs de troubles sanguins tels que fièvre persistante, contusions, saignements, pâleur.
INFORMER LE MEDECIN DES QUE POSSIBLE en cas de :
- Signes d'infection tels que fièvre, malaise, plaies, problèmes dentaires, brûlures en urinant.
- Sensation de faiblesse ou de fatigue.
- Toux.
- Fourmillements.
- Engourdissement.
- Vision double.
- Faiblesse des bras ou des jambes.
- "Bouton" ou de plaie ouverte qui ne cicatrise pas.
PREVENIR LE MEDECIN en cas de :
-
Voyage prévu dans les régions où les infections fongiques telles
qu'histoplasmose, coccidioïdomycose ou blastomycose sont endémiques ou dans les régions à haut risque de tuberculose.
- Intervention chirurgicale programmée.
Les femmes en âge de procréer doivent utiliser une méthode de CONTRACEPTION pendant le traitement et pendant au moins 5 mois après l'arrêt du traitement.
PRUDENCE EN CAS DE CONDUITE DE VEHICULES ET UTILISATION DE MACHINES (vertiges possibles et troubles de la vision après l'injection).
Femmes en âge de procréer
Les femmes en âge de procréer doivent envisager l'utilisation d'une contraception efficace pendant le traitement par Amsparity et la poursuivre pendant cinq mois au moins après la dernière administration d'Amsparity.
Grossesse
Un grand nombre (environ 2 100) de grossesses exposées à l'adalimumab dont les données ont été recueillies prospectivement, aboutissant à une naissance vivante avec une évolution à terme connue, avec notamment plus de 1 500 grossesses exposées à l'adalimumab au cours du premier trimestre, ne révèle aucune augmentation du taux de malformations chez le nouveau-né.
Au cours d'une étude de cohorte prospective, 257 femmes présentant une polyarthrite rhumatoïde (PR) ou une maladie de Crohn (MC) et traitées par adalimumab au moins pendant le premier trimestre et 120 femmes présentant une PR ou une MC non traitées par adalimumab ont été incluses. La prévalence à la naissance des anomalies congénitales majeures constituait le critère d'évaluation principal. Le taux de grossesses aboutissant à au moins un nouveau-né en vie présentant une anomalie congénitale majeure était de 6/69 (8,7 %) chez les femmes traitées par adalimumab présentant une PR et de 5/74 (6,8 %) chez les femmes non traitées présentant une PR (OR non ajusté 1,31, IC à 95 % 0,38 - 4,52), et de 16/152 (10,5 %) chez les femmes traitées par adalimumab présentant une MC et de 3/32 (9,4 %) chez les femmes non traitées présentant une MC (OR non ajusté 1,14, IC à 95 % 0,31 - 4,16). L'OR ajusté (compte tenu des différences initiales) était de 1,10 (IC à 95 % 0,45 - 2,73) pour les PR et MC combinées. Aucune différence notable n'a été rapportée entre les femmes traitées par adalimumab et les femmes non traitées pour les critères d'évaluation secondaires d'avortements spontanés, d'anomalies congénitales mineures, d'accouchement prématuré, de taille à la naissance et d'infections graves ou opportunistes, et aucune mortinatalité ou tumeur maligne n'a été rapportée. L'interprétation des données peut être affectée en raison des limites méthodologiques de l'étude, notamment la petite taille d'échantillon et le plan d'étude non randomisé.
Dans une étude de toxicité sur le développement réalisée chez des singes, il n'y a eu aucun signe évocateur d'une éventuelle toxicité maternelle, d'une embryo-toxicité ou de potentiel tératogène. On ne dispose pas de données précliniques sur la toxicité post-natale de l'adalimumab (voir rubrique Données de sécurité préclinique).
En raison de son effet inhibiteur sur le TNFα, l'adalimumab administré pendant la grossesse pourrait affecter les réponses immunitaires normales du nouveau-né. L'adalimumab doit être utilisé pendant la grossesse seulement si nécessaire.
Chez les femmes traitées par adalimumab durant leur grossesse, l'adalimumab peut traverser le placenta et passer dans le sang de leur enfant. En conséquence, ces enfants peuvent avoir un risque accru d'infections. L'administration de vaccins vivants (par exemple, vaccin BCG) à des enfants qui ont été exposés à l'adalimumab in utero n'est pas recommandée pendant les 5 mois suivant la dernière injection d'adalimumab chez la mère pendant la grossesse.
Allaitement
Des données limitées issues de la littérature publiée indiquent que l'adalimumab est excrété dans le lait maternel à de très faibles concentrations, l'adalimumab étant présent dans le lait maternel à des concentrations équivalant à 0,1 % - 1 % des taux sériques maternels. Administrées par voie orale, les protéines immunoglobulines G subissent une protéolyse intestinale et présentent une faible biodisponibilité. Aucun effet sur les nouveau-nés/nourrissons allaités n'est attendu. Par conséquent, Amsparity peut être utilisé pendant l'allaitement.
Fertilité
On ne dispose pas de données précliniques sur les effets de l'adalimumab sur la fertilité.
L'adalimumab a été étudié chez des patients atteints de polyarthrite rhumatoïde, d'arthrite juvénile idiopathique polyarticulaire et de rhumatisme psoriasique prenant l'adalimumab en monothérapie et chez ceux prenant simultanément du méthotrexate. La formation d'anticorps était plus faible lorsque l'adalimumab était administré en même temps que du méthotrexate par comparaison avec son utilisation en monothérapie. L'administration d'adalimumab sans méthotrexate a entraîné une augmentation de la formation d'anticorps, une augmentation de la clairance et une réduction de l'efficacité de l'adalimumab (voir rubrique Propriétés pharmacodynamiques).
L'association d'Amsparity et d'anakinra n'est pas recommandée (voir rubrique Mises en garde spéciales et précautions d'emploi « Administration simultanée de traitements de fond (DMARDs) biologiques ou antagonistes du TNF »).
L'association d'Amsparity et d'abatacept n'est pas recommandée (voir rubrique Mises en garde spéciales et précautions d'emploi « Administration simultanée de traitements de fond (DMARDs) biologiques ou antagonistes du TNF »).
Le traitement par Amsparity doit être instauré et supervisé par un médecin spécialiste qualifié en matière de diagnostic et de traitement des pathologies dans lesquelles Amsparity est indiqué. Il est recommandé aux ophtalmologistes de consulter un spécialiste approprié avant d'instaurer un traitement par Amsparity (voir rubrique Mises en garde spéciales et précautions d'emploi). Une carte de rappel patient sera remise aux patients traités par Amsparity.
Après une formation correcte à la technique d'injection, les patients peuvent s'auto-injecter Amsparity, si leur médecin l'estime possible, sous le couvert d'un suivi médical approprié.
Pendant le traitement par Amsparity, les autres traitements concomitants (tels que les corticoïdes et/ou immunomodulateurs) devront être optimisés.
Posologie
Polyarthrite rhumatoïde
Chez les patients adultes atteints de polyarthrite rhumatoïde, la posologie recommandée d'Amsparity est une dose unique de 40 mg d'adalimumab administrée toutes les deux semaines, par voie souscutanée. L'administration de méthotrexate doit être continuée pendant le traitement par Amsparity.
Les glucocorticoïdes, les salicylés, les anti-inflammatoires non stéroïdiens ou les antalgiques peuvent être poursuivis pendant le traitement par Amsparity. En ce qui concerne l'association aux traitements de fond antirhumatismaux autres que le méthotrexate, voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques.
En monothérapie, certains patients chez qui l'on observe une diminution de leur réponse à Amsparity 40 mg toutes les deux semaines, peuvent bénéficier d'une augmentation de la posologie à 40 mg d'adalimumab toutes les semaines ou 80 mg toutes les deux semaines.
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement. La poursuite du traitement devra être reconsidérée chez un patient n'ayant pas répondu dans ces délais.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Interruption du traitement
Il peut être nécessaire d'interrompre le traitement, par exemple avant une intervention chirurgicale ou en cas d'infection sévère. Les données disponibles suggèrent que la ré-introduction de l'adalimumab après un arrêt de 70 jours ou plus entraîne une réponse clinique de même ampleur et un profil de tolérance similaire à celui observé avant l'interruption du traitement.
Spondylarthrite ankylosante, spondyloarthrite axiale sans signes radiographiques de SA et rhumatisme psoriasique
La posologie recommandée d'Amsparity pour les patients atteints de spondylarthrite ankylosante, de spondyloarthrite axiale sans signes radiographiques de SA et pour les patients atteints de rhumatisme psoriasique est de 40 mg d'adalimumab en dose unique toutes les deux semaines, en injection souscutanée.
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement. La poursuite du traitement devra être reconsidérée chez un patient n'ayant pas répondu dans ces délais.
Psoriasis
La posologie recommandée d'Amsparity pour débuter le traitement chez l'adulte est de 80 mg par voie sous-cutanée. La posologie se poursuivra une semaine après par 40 mg en voie sous-cutanée toutes les deux semaines.
La poursuite du traitement au-delà de 16 semaines doit être soigneusement reconsidérée chez un patient n'ayant pas répondu dans ces délais.
Au-delà de 16 semaines, en cas de réponse insuffisante à Amsparity 40 mg toutes les deux semaines, les patients peuvent bénéficier d'une augmentation de la posologie à 40 mg toutes les semaines ou 80 mg toutes les deux semaines. Les bénéfices et les risques d'un traitement continu de 40 mg toutes les semaines ou 80 mg toutes les deux semaines doivent être soigneusement reconsidérés chez un patient en cas de réponse insuffisante après l'augmentation de la posologie (voir rubrique Propriétés pharmacodynamiques). En cas de réponse suffisante obtenue avec 40 mg toutes les semaines ou 80 mg toutes les deux semaines, la posologie peut ensuite être réduite à 40 mg toutes les deux semaines.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Hidrosadénite suppurée
Le schéma posologique recommandé d'Amsparity chez les patients adultes atteints d'hidrosadénite suppurée (HS) est d'une dose initiale de 160 mg au Jour 1 (administrée sous forme de 4 injections de 40 mg sur un jour ou de 2 injections de 40 mg par jour pendant deux jours consécutifs), suivie d'une dose de 80 mg deux semaines après au Jour 15 (administrée sous forme de 2 injections de 40 mg sur un jour). Deux semaines plus tard (Jour 29), poursuivre avec une dose de 40 mg toutes les semaines ou de 80 mg toutes les deux semaines (administrés sous forme de deux injections de 40 mg par jour). Si nécessaire, les antibiotiques peuvent être poursuivis au cours du traitement par Amsparity. Au cours du traitement par Amsparity, il est recommandé au patient de nettoyer quotidiennement ses lésions d'HS avec un antiseptique topique.
La poursuite du traitement au-delà de 12 semaines doit être soigneusement reconsidérée chez les patients ne présentant pas d'amélioration pendant cette période.
Si le traitement est interrompu, Amsparity 40 mg toutes les semaines ou 80 mg toutes les deux semaines pourrait être réintroduit (voir rubrique Propriétés pharmacodynamiques).
Le bénéfice et le risque d'un traitement continu à long terme doivent faire l'objet d'une évaluation régulière (voir rubrique Propriétés pharmacodynamiques).
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Maladie de Crohn
Chez les patients adultes atteints de maladie de Crohn active modérée à sévère, le schéma posologique d'induction recommandé d'Amsparity est de 80 mg à la semaine 0, suivis de 40 mg à la semaine 2. S'il est nécessaire d'obtenir une réponse plus rapide au traitement, le schéma 160 mg à la semaine 0 (administrés sous forme de 4 injections de 40 mg par jour ou de 2 injections de 40 mg par jour pendant deux jours consécutifs), puis 80 mg à la semaine 2 (administrés sous forme de deux injections de 40 mg par jour), peut être utilisé sachant que le risque d'événements indésirables est plus élevé pendant cette phase d'induction.
Après le traitement d'induction, la posologie recommandée est une dose de 40 mg administrée toutes les deux semaines, en injection sous-cutanée. Si un patient a arrêté le traitement par Amsparity et si les signes et symptômes de la maladie réapparaissent, Amsparity pourra être ré-administré. L'expérience de la ré-administration du traitement au-delà de 8 semaines après la dose précédente est limitée.
Pendant le traitement d'entretien, les corticoïdes pourront être progressivement diminués conformément aux recommandations de pratique clinique.
Certains patients chez qui une diminution de la réponse par Amsparity 40 mg toutes les deux semaines est observée, peuvent bénéficier d'une augmentation de la posologie à 40 mg d'Amsparity toutes les semaines ou 80 mg toutes les deux semaines.
Certains patients n'ayant pas répondu au traitement à la semaine 4 peuvent poursuivre le traitement d'entretien jusqu'à la semaine 12. La poursuite du traitement devra être soigneusement reconsidérée chez un patient n'ayant pas répondu dans ces délais.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
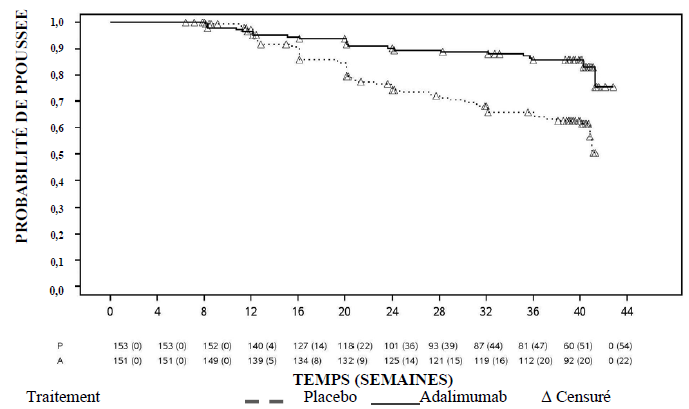
Rectocolite hémorragique
Chez les patients adultes atteints de rectocolite hémorragique modérée à sévère, le schéma posologique d'induction recommandé d'Amsparity est de 160 mg à la semaine 0 (administrés sous forme de 4 injections de 40 mg par jour ou de 2 injections de 40 mg par jour pendant deux jours consécutifs) et de 80 mg à la semaine 2 (administrés sous forme de deux injections de 40 mg par jour). Après le traitement d'induction, la posologie recommandée est de 40 mg administrée toutes les deux semaines, en injection sous-cutanée.
Pendant le traitement d'entretien, les corticoïdes pourront être progressivement diminués conformément aux recommandations de pratique clinique.
Certains patients chez qui une diminution de la réponse au traitement par Amsparity 40mg toutes les deux semaines est observée, peuvent bénéficier d'une augmentation de la posologie à 40 mg d'Amsparity toutes les semaines ou 80 mg toutes les deux semaines.
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 2 à 8 semaines de traitement. Le traitement par Amsparity ne doit pas être poursuivi chez les patients n'ayant pas répondu dans ces délais.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
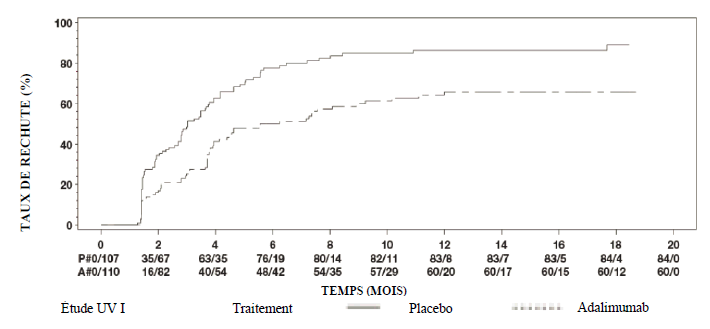
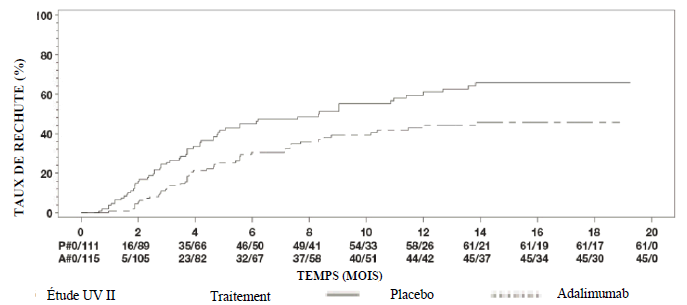
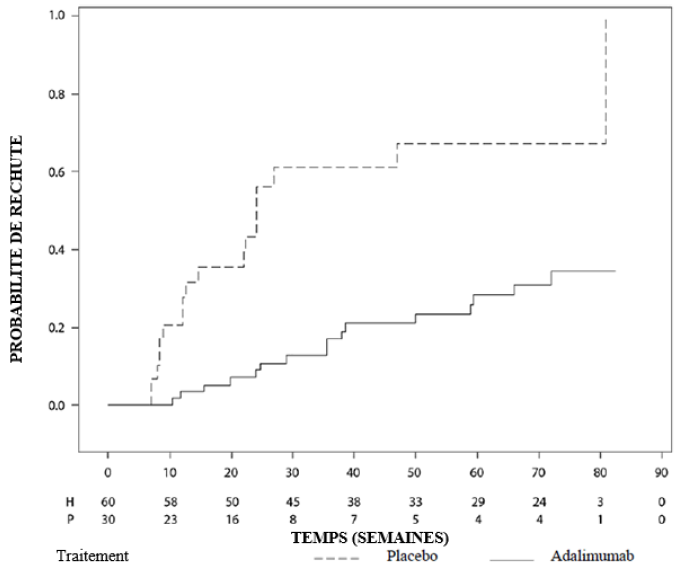
Uvéite
Chez les patients adultes atteints d'uvéite, la posologie recommandée d'Amsparity est d'une dose initiale de 80 mg suivie d'une dose de 40 mg toutes les deux semaines en commençant une semaine après l'administration de la première dose. L'expérience sur l'instauration du traitement par Amsparity en monothérapie est limitée. Le traitement par Amsparity peut être débuté en association avec une corticothérapie et/ou avec d'autres traitements immunomodulateurs non biologiques. La dose de corticoïdes associée peut être progressivement diminuée conformément à la pratique clinique, en débutant deux semaines après l'instauration du traitement par Amsparity.
Une réévaluation annuelle des bénéfices et des risques associés au traitement continu à long terme est recommandée (voir rubrique Propriétés pharmacodynamiques).
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Populations particulières
Sujets âgés
Aucun ajustement de la posologie n'est nécessaire.
Insuffisants rénaux et/ou hépatiques
L'adalimumab n'a pas été étudié dans ces populations de patients. Il n'est pas possible de recommander des posologies.
Population pédiatrique
Arthrite juvénile idiopathique
Arthrite juvénile idiopathique polyarticulaire à partir de 2 ans
La posologie recommandée d'Amsparity pour les patients atteints d'arthrite juvénile idiopathique polyarticulaire à partir de l'âge de 2 ans dépend du poids corporel (tableau 1). Amsparity est administré toutes les deux semaines en injection sous-cutanée.
Tableau 1.
Posologie d'Amsparity chez les patients atteints d'arthrite juvénile idiopathique polyarticulaire
|
Poids du patient |
Schéma posologique |
|
10 kg à < 30 kg |
20 mg toutes les deux semaines |
|
≥ 30 kg |
40 mg toutes les deux semaines |
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement. La poursuite du traitement devra être soigneusement reconsidérée chez un patient n'ayant pas répondu dans ces délais.
Il n'y a pas d'utilisation justifiée de l'adalimumab chez les patients âgés de moins de 2 ans dans cette indication.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Arthrite liée à l'enthésite
La posologie recommandée d'Amsparity pour les patients atteints d'arthrite liée à l'enthésite à partir de l'âge de 6 ans dépend du poids corporel (tableau 2). Amsparity est administré toutes les deux semaines en injection sous-cutanée.
Tableau 2.
Posologie d'Amsparity chez les patients atteints d'arthrite liée à l'enthésite
|
Poids du patient |
Schéma posologique |
|
15 kg à < 30 kg |
20 mg toutes les deux semaines |
|
≥ 30 kg |
40 mg toutes les deux semaines |
L'adalimumab n'a pas été étudié chez les patients de moins de 6 ans atteints d'arthrite liée à l'enthésite.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Rhumatisme psoriasique et spondyloarthrite axiale y compris spondylarthrite ankylosante
Il n'y a pas d'utilisation justifiée de l'adalimumab dans la population pédiatrique dans les indications de spondylarthrite ankylosante et de rhumatisme psoriasique.
Psoriasis en plaques pédiatrique
La posologie recommandée d'Amsparity pour les patients atteints de psoriasis en plaques âgés de 4 à 17 ans dépend du poids corporel (tableau 3). Amsparity est administré en injection sous-cutanée.
Tableau 3.
Posologie d'Amsparity chez les enfants et les adolescents atteints de psoriasis en plaques
|
Poids du patient |
Schéma posologique |
|
15 kg à < 30 kg |
Dose initiale de 20 mg puis 20 mg toutes les deux semaines en commençant une semaine après l'administration de la dose initiale. |
|
≥ 30 kg |
Dose initiale de 40 mg puis 40 mg toutes les deux semaines en commençant une semaine après l'administration de la dose initiale. |
La poursuite du traitement au-delà de 16 semaines doit être soigneusement reconsidérée chez un patient n'ayant pas répondu dans ces délais.
Si un retraitement par Amsparity est indiqué, les recommandations ci-dessus pour la posologie et la durée de traitement doivent être suivies.
La tolérance de l'adalimumab chez l'enfant et l'adolescent présentant un psoriasis en plaques a été évaluée sur une durée moyenne de 13 mois.
Il n'y a pas d'utilisation justifiée de l'adalimumab chez les enfants âgés de moins de 4 ans dans cette indication.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Hidrosadénite suppurée de l'adolescent (à partir de 12 ans, pesant au moins 30 kg)
Il n'existe pas d'essai clinique conduit avec l'adalimumab chez des adolescents atteints d'HS. La posologie de l'adalimumab chez ces patients a été déterminée à partir d'une modélisation pharmacocinétique et d'une simulation (voir rubrique Propriétés pharmacocinétiques).
La posologie recommandée d'Amsparity est de 80 mg à la semaine 0 suivie de 40 mg toutes les deux semaines à partir de la semaine 1 en injection sous-cutanée.
Chez les adolescents avec une réponse insuffisante à Amsparity 40 mg toutes les deux semaines, une augmentation de la posologie à 40 mg toutes les semaines ou 80 mg toutes les deux semaines peut être envisagée.
Si nécessaire, les antibiotiques peuvent être poursuivis au cours du traitement par Amsparity. Au cours du traitement par Amsparity, il est recommandé au patient de nettoyer quotidiennement ses lésions d'HS avec un antiseptique topique.
La poursuite du traitement au-delà de 12 semaines doit être soigneusement reconsidérée chez les patients ne présentant pas d'amélioration pendant cette période.
Si le traitement est interrompu, Amsparity pourrait être réintroduit si nécessaire.
Le bénéfice et le risque d'un traitement continu à long terme doivent faire l'objet d'une évaluation régulière (voir les données chez les adultes à la rubrique Propriétés pharmacodynamiques).
Il n'y a pas d'utilisation justifiée de l'adalimumab chez les enfants âgés de moins de 12 ans dans cette indication.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Maladie de Crohn pédiatrique
La posologie recommandée d'Amsparity pour les patients atteints de la maladie de Crohn âgés de 6 à 17 ans dépend du poids corporel (tableau 4). Amsparity est administré en injection sous-cutanée.
Tableau 4.
Posologie d'Amsparity chez les enfants et les adolescents atteints de la maladie de Crohn
|
Poids du patient |
Dose d'induction |
Dose d'entretien à partir de la semaine 4 |
|
< 40 kg |
• 40 mg à la semaine 0 et 20 mg à la semaine 2 S'il est nécessaire d'obtenir une réponse plus rapide au traitement et sachant que le risque d'événements indésirables peut être plus important avec une dose d'induction élevée, la posologie suivante peut être utilisée : • 80 mg à la semaine 0 et 40 mg à la semaine 2 |
20 mg toutes les deux semaines |
|
≥ 40 kg |
• 80 mg à la semaine 0 et 40 mg à la semaine 2 S'il est nécessaire d'obtenir une réponse plus rapide au traitement et sachant que le risque d'événements indésirables peut être plus important avec une dose d'induction élevée, la posologie suivante peut être utilisée : • 160 mg à la semaine 0 et 80 mg à la semaine 2 |
40 mg toutes les deux semaines |
Les patients chez qui une réponse insuffisante au traitement est observée peuvent bénéficier d'une augmentation de la posologie :
- < 40 kg : 20 mg toutes les semaines
- ≥ 40 kg : 40 mg toutes les semaines ou 80 mg toutes les deux semaines
La poursuite du traitement devra être soigneusement reconsidérée chez un patient n'ayant pas répondu à la semaine 12.
Il n'y a pas d'utilisation justifiée de l'adalimumab chez les enfants âgés de moins de 6 ans dans cette indication.
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Rectocolite hémorragique pédiatrique
La posologie recommandée d'Amsparity pour les patients âgés de 6 à 17 ans et atteints de rectocolite hémorragique dépend du poids corporel (tableau 5). Amsparity est administré par injection souscutanée.
Tableau 5.
Posologie d'Amsparity chez les patients pédiatriques atteints de rectocolite hémorragique
|
Poids du patient |
Dose d'induction |
Dose d'entretien à partir de la semaine 4* |
|
|
< 40 kg |
|
80 mg à la semaine 0 (deux injections de 40 mg le jour de l'induction) et 40 mg à la semaine 2 (une seule injection de 40 mg) |
40 mg toutes les deux semaines |
|
Poids du patient |
Dose d'induction |
Dose d'entretien à partir de la semaine 4* |
|
|
≥ 40 kg |
|
160 mg à la semaine 0 (quatre injections de 40 mg le jour de l'induction ou deux injections de 40 mg par jour pendant deux jours) et 80 mg à la semaine 2 (deux injections de 40 mg le jour de l'injection) |
80 mg toutes les deux semaines |
* Pour les patients pédiatriques atteignant l'âge de 18 ans pendant le traitement par Amsparity, la dose d'entretien prescrite doit être maintenue.
La poursuite du traitement au-delà de 8 semaines doit être soigneusement reconsidérée chez les patients n'ayant pas répondu pendant cette période.
Il n'y a pas d'utilisation justifiée de l'adalimumab chez les enfants âgés de moins de 6 ans dans cette indication.
Différents dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Uvéite pédiatrique
La posologie recommandée d'Amsparity pour les enfants et les adolescents atteints d'uvéite à partir de l'âge de 2 ans dépend du poids corporel (tableau 6). Amsparity est administré en injection souscutanée.
Dans l'uvéite pédiatrique, aucun essai clinique n'a été conduit avec l'adalimumab sans traitement concomitant par le méthotrexate.
Tableau 6.
Posologie d'Amsparity chez les enfants et les adolescents atteints d'uvéite
|
Poids du patient |
Schéma posologique |
|
< 30 kg |
20 mg toutes les deux semaines en association avec du méthotrexate |
|
≥ 30 kg |
40 mg toutes les deux semaines en association avec du méthotrexate |
Lors de l'instauration du traitement par Amsparity, une dose de charge de 40 mg pour les patients ayant un poids < 30 kg ou de 80 mg pour ceux ayant un poids ≥ 30 kg peut être administrée une semaine avant le début du traitement d'entretien. Aucune donnée clinique n'est disponible sur l'utilisation d'une dose de charge d'Amsparity chez les enfants âgés de moins de 6 ans (voir rubrique Propriétés pharmacocinétiques).
Il n'y a pas d'utilisation justifiée de l'adalimumab chez les enfants âgés de moins de 2 ans dans cette indication.
Une réévaluation annuelle des bénéfices et des risques associés au traitement continu à long terme est recommandée (voir rubrique Propriétés pharmacodynamiques).
D'autres dosages et/ou présentations d'Amsparity peuvent être disponibles en fonction des besoins thérapeutiques de chaque patient.
Mode d'administration
Amsparity est administré en injection sous-cutanée. Les instructions complètes d'utilisation sont fournies dans la notice.
D'autres dosages et présentations d'Amsparity sont disponibles.
Durée de conservation :
3 ans
Précautions particulières de conservation :
À conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. Conserver la seringue préremplie dans son emballage extérieur à l'abri de la lumière.
Une seringue préremplie d'Amsparity peut être maintenue à des températures allant jusqu'à 30 °C pendant 30 jours maximum à l'abri de la lumière. Après cette période, la seringue doit être jetée.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Aucune toxicité limitant la dose n'a été observée dans les essais cliniques. La plus forte dose évaluée était constituée de doses intraveineuses répétées de 10 mg/kg, ce qui représente environ 15 fois la dose recommandée.
Classe pharmacothérapeutique : Immunosuppresseurs, inhibiteurs du facteur de nécrose tumorale alpha (TNF-α). Code ATC : L04AB04
Amsparity est un médicament biosimilaire. Des informations détaillées sont disponibles sur le site internet de l'Agence européenne des médicaments https://www.ema.europa.eu.
Mécanisme d'action
L'adalimumab se lie spécifiquement au TNF dont il neutralise la fonction biologique en bloquant son interaction avec les récepteurs du TNF p55 et p75 situés à la surface cellulaire.
L'adalimumab module aussi les réponses biologiques induites ou régulées par le TNF, y compris les variations des taux des molécules d'adhésion responsables de la migration des leucocytes (ELAM-1, VCAM-1, et ICAM-1 avec une CI50 de 0,1-0,2 nM).
Effets pharmacodynamiques
Après traitement par adalimumab chez des patients atteints de polyarthrite rhumatoïde, on a observé une diminution rapide du taux des réactifs de la phase aiguë de l'inflammation (protéine réactive C (CRP) et vitesse de sédimentation des érythrocytes [VSE]) et des cytokines sériques [IL-6] par rapport aux valeurs initialement observées. L'administration d'adalimumab est également associée à une diminution des taux sériques des métalloprotéinases matricielles (MMP-1 et MMP-3) qui permettent le remodelage tissulaire responsable de la destruction cartilagineuse. Les patients traités par adalimumab présentent généralement une amélioration des signes hématologiques de l'inflammation chronique.
Une diminution rapide du taux de CRP a également été observée chez les patients atteints d'arthrite juvénile idiopathique polyarticulaire, de la maladie de Crohn, de rectocolite hémorragique et d'hidrosadénite suppurée après traitement par adalimumab. Chez les patients atteints de la maladie de Crohn, une réduction du nombre de cellules exprimant les marqueurs de l'inflammation dans le côlon y compris une réduction significative de l'expression du TNFα a été observée. Des études endoscopiques sur la muqueuse intestinale ont mis en évidence une cicatrisation de la muqueuse chez les patients traités par adalimumab.
Efficacité et sécurité cliniques
Polyarthrite rhumatoïde
L'adalimumab a fait l'objet d'études chez plus de 3 000 patients dans l'ensemble des essais cliniques dans la polyarthrite rhumatoïde. L'efficacité et le profil de tolérance de l'adalimumab ont été évalués dans cinq études contrôlées randomisées, en double aveugle. Certains patients ont été traités pendant 120 mois.
L'étude I sur la PR a porté sur 271 patients atteints de polyarthrite rhumatoïde active modérée à sévère, âgés de 18 ans et plus et chez qui le traitement par au moins un DMARD avait échoué et chez qui le méthotrexate à la posologie de 12,5 à 25 mg/semaine (10 mg en cas d'intolérance au méthotrexate), s'était avéré insuffisamment efficace alors que la dose de méthotrexate était restée constante de 10 à 25 mg par semaine. Ces patients ont reçu 20, 40 ou 80 mg d'adalimumab ou un placebo toutes les deux semaines pendant 24 semaines.
L'étude II sur la PR a évalué 544 patients atteints de polyarthrite rhumatoïde active modérée à sévère, âgés de 18 ans et plus et chez qui le traitement par au moins un DMARD avait échoué. Les patients ont été traités par 20 ou 40 mg d'adalimumab par voie sous-cutanée toutes les deux semaines en alternance avec un placebo, ou chaque semaine pendant 26 semaines ; un placebo a été administré toutes les semaines pendant la même durée. Aucun autre DMARD n'était autorisé.
L'étude III sur la PR a évalué 619 patients atteints de polyarthrite rhumatoïde active modérée à sévère, âgés de 18 ans et plus qui n'avaient pas présenté de réponse au méthotrexate aux doses de 12,5 à 25 mg ou qui ne toléraient pas une dose de 10 mg de méthotrexate une fois par semaine. L'étude a comporté trois groupes : le premier a reçu des injections hebdomadaires de placebo pendant 52 semaines, le deuxième a reçu 20 mg d'adalimumab toutes les semaines pendant 52 semaines et le troisième a été traité par 40 mg d'adalimumab toutes les deux semaines en alternance avec le placebo. Après la fin de la première période de 52 semaines, 457 patients ont été inclus dans une phase d'extension en ouvert au cours de laquelle l'adalimumab a été administré à la dose de 40 mg toutes les deux semaines en association au méthotrexate pendant 10 ans.
L'étude IV sur la PR a évalué principalement la tolérance chez 636 patients atteints de polyarthrite rhumatoïde active modérée à sévère et âgés de 18 ans et plus. Les patients pouvaient n'avoir jamais reçu de DMARD ou pouvaient poursuivre leur traitement rhumatologique préexistant pourvu que ce dernier soit stable depuis au moins 28 jours. Ces traitements comprenaient le méthotrexate, le léflunomide, l'hydroxychloroquine, la sulfasalazine et/ou les sels d'or. Les patients après randomisation ont reçu soit 40 mg d'adalimumab soit un placebo toutes les deux semaines pendant 24 semaines.
L'étude V sur la PR a évalué 799 patients adultes naïfs de méthotrexate ayant une polyarthrite rhumatoïde active modérée à sévère, récente (durée moyenne de la maladie inférieure à 9 mois). Cette étude a évalué l'efficacité de l'association adalimumab à la dose de 40 mg toutes les deux semaines/méthotrexate, adalimumab à la dose de 40 mg toutes les deux semaines en monothérapie et une monothérapie de méthotrexate pour réduire les signes et symptômes et le taux de progression des dommages articulaires dans la polyarthrite rhumatoïde, pendant 104 semaines. Après la fin de la première période de 104 semaines, 497 patients ont été inclus dans une phase d'extension en ouvert au cours de laquelle l'adalimumab a été administré à la dose de 40 mg toutes les deux semaines jusqu'à 10 ans.
Le critère d'évaluation principal des études I, II et III sur la PR et le critère d'évaluation secondaire de l'étude IV sur la PR étaient le pourcentage de patients ayant obtenu une réponse ACR 20 à la 24e ou la 26e semaine. Le critère d'évaluation principal dans l'étude V sur la PR était le pourcentage de patients qui avaient obtenu une réponse ACR 50 à la semaine 52. Les études III et V sur la PR avaient un critère d'évaluation principal supplémentaire à 52 semaines à savoir le retard de progression de la maladie (attesté par les résultats radiologiques). L'étude III sur la PR avait aussi comme critère d'évaluation principal les modifications de la qualité de vie.
Réponse ACR
Le pourcentage de patients sous adalimumab qui ont obtenu une réponse ACR 20, 50 ou 70 a été cohérent dans les études I, II et III sur la PR. Le tableau 8 résume les résultats obtenus à la posologie de 40 mg toutes les deux semaines.
Tableau 8.
Réponses ACR dans les essais contrôlés contre placebo (pourcentage de patients)
|
Réponse |
Étude Ia** sur la PR |
Étude IIa** sur la PR |
Étude IIIa** sur la PR |
|||
|
Placebo/ MTXc n = 60 |
Adalimumab b/MTXc n = 63 |
Placebo n = 110 |
Adalimumabb n = 113 |
Placebo /MTXc n = 200 |
Adalimumabb /MTXc n = 207 |
|
|
ACR 20 |
|
|
|
|
|
|
|
6 mois |
13,3 % |
65,1 % |
19,1 % |
46,0 % |
29,5 % |
63,3 % |
|
12 mois |
NA |
NA |
NA |
NA |
24,0 % |
58,9 % |
|
ACR 50 |
|
|
|
|
|
|
|
6 mois |
6,7 % |
52,4 % |
8,2 % |
22,1 % |
9,5 % |
39,1 % |
|
12 mois |
NA |
NA |
NA |
NA |
9,5 % |
41,5 % |
|
ACR 70 |
|
|
|
|
|
|
|
6 mois |
3,3 % |
23,8 % |
1,8 % |
12,4 % |
2,5 % |
20,8 % |
|
12 mois |
NA |
NA |
NA |
NA |
4,5 % |
23,2 % |
a Étude I sur la PR à 24 semaines, étude II sur la PR à 26
semaines et étude III sur la PR à 24 et 52 semaines
b 40 mg d'adalimumab administré toutes les deux semaines
c MTX = méthotrexate
** p < 0,01, adalimumab versus placebo
b 40 mg d'adalimumab administré toutes les deux semaines
c MTX = méthotrexate
** p < 0,01, adalimumab versus placebo
Dans les études I-IV sur la PR, les composantes individuelles des critères de réponse de l'ACR (nombre d'articulations sensibles et tuméfiées, évaluation par le médecin et le patient de l'activité de la maladie et de la douleur, indice d'invalidité (HAQ) et valeurs de la CRP [mg/dl]) ont été améliorées à 24 ou 26 semaines par rapport au placebo. Dans l'étude III sur la PR, ces améliorations se sont maintenues tout au long des 52 semaines.
Dans la phase d'extension en ouvert de l'étude III sur la PR, les taux de réponse ACR ont été maintenus chez la plupart des patients suivis jusqu'à 10 ans. Sur 207 patients randomisés pour recevoir l'adalimumab 40 mg toutes les deux semaines, 114 patients ont poursuivi l'adalimumab à la dose de 40 mg toutes les deux semaines pendant 5 ans. Parmi ces patients, 86 patients (75,4 %) ont eu une réponse ACR 20 ; 72 patients (63,2 %) ont eu une réponse ACR 50 et 41 patients (36 %) ont eu une réponse ACR 70. Sur 207 patients, 81 patients ont poursuivi l'adalimumab à la dose de 40 mg toutes les deux semaines pendant 10 ans. Parmi ces patients, 64 patients (79,0 %) ont eu une réponse ACR 20 ; 56 patients (69,1 %) ont eu une réponse ACR 50 et 43 patients (53,1 %) ont eu une réponse ACR 70.
Dans l'étude IV sur la PR, la réponse ACR 20 des patients traités par adalimumab en plus des soins habituels a été significativement meilleure que chez les patients recevant le placebo plus les soins habituels (p < 0,001).
Dans les études I-IV sur la PR, les réponses ACR 20 et 50 des patients traités par adalimumab ont été statistiquement significatives par rapport au placebo dès la première ou la deuxième semaine de traitement.
Dans l'étude V sur la PR chez des patients ayant une polyarthrite rhumatoïde récente, naïfs de méthotrexate, un traitement associant de l'adalimumab et du méthotrexate a conduit à des réponses ACR plus rapides et significativement plus importantes qu'avec le méthotrexate seul et l'adalimumab seul, à la semaine 52 et les réponses étaient maintenues à la semaine 104 (voir tableau 9).
Tableau 9.
Réponses ACR dans l'étude V sur la PR (pourcentage de patients)
|
Réponse |
MTX n = 257 |
Adalimumab n = 274 |
Adalimumab/MT X n = 268 |
Valeur de pa |
Valeur de pb |
Valeur de pc |
|
ACR 20 |
|
|
|
|
|
|
|
Semaine 52 |
62,6 % |
54,4 % |
72,8 % |
0,013 |
< 0,001 |
0,043 |
|
Semaine 10 4 |
56,0 % |
49,3 % |
69,4 % |
0,002 |
< 0,001 |
0,140 |
|
ACR 50 |
|
|
|
|
|
|
|
Semaine 52 |
45,9 % |
41,2 % |
61,6 % |
< 0,001 |
< 0,001 |
0,317 |
|
Semaine 10 4 |
42,8 % |
36,9 % |
59,0 % |
< 0,001 |
< 0,001 |
0,162 |
|
ACR 70 |
|
|
|
|
|
|
|
Semaine 52 |
27,2 % |
25,9 % |
45,5 % |
< 0,001 |
< 0,001 |
0,656 |
|
Semaine 10 4 |
28,4 % |
28,1 % |
46,6 % |
< 0,001 |
< 0,001 |
0,864 |
a
La valeur
de p résulte de la comparaison appariée des traitements par méthotrexate
seul et par l'association adalimumab/méthotrexate par le test U de
Mann-Whitney.
b La valeur de p résulte de la comparaison appariée des traitements par adalimumab seul et par l'association adalimumab/méthotrexate par le test U de Mann-Whitney.
c La valeur de p résulte de la comparaison appariée des traitements par adalimumab seul et par méthotrexate seul par le test U de Mann-Whitney.
b La valeur de p résulte de la comparaison appariée des traitements par adalimumab seul et par l'association adalimumab/méthotrexate par le test U de Mann-Whitney.
c La valeur de p résulte de la comparaison appariée des traitements par adalimumab seul et par méthotrexate seul par le test U de Mann-Whitney.
Dans la phase d'extension en ouvert de l'étude V sur la PR, les taux de réponse ACR ont été maintenus chez les patients suivis jusqu'à 10 ans. Sur 542 patients randomisés pour recevoir l'adalimumab 40 mg toutes les deux semaines, 170 patients ont poursuivi l'adalimumab à la dose de 40 mg toutes les deux semaines pendant 10 ans. Parmi ces patients, 154 patients (90,6 %) ont eu une réponse ACR 20 ; 127 patients (74,7 %) ont eu une réponse ACR 50 et 102 patients (60,0 %) ont eu une réponse ACR 70.
À la semaine 52, 42,9 % des patients qui avaient reçu l'association adalimumab/méthotrexate étaient en rémission clinique (DAS 28 (CRP) < 2,6) comparativement à 20,6 % des patients ayant reçu le méthotrexate seul et 23,4 % des patients ayant reçu l'adalimumab seul. Le traitement par l'association adalimumab/méthotrexate était cliniquement et statistiquement supérieur au méthotrexate (p < 0,001) et à l'adalimumab en monothérapie (p < 0,001) dans l'obtention d'un état d'activité basse de la maladie pour les patients chez qui une polyarthrite rhumatoïde modérée à sévère avait été récemment diagnostiquée. La réponse pour les deux bras de monothérapie était similaire (p = 0,447). Sur 342 patients initialement randomisés pour recevoir l'adalimumab seul ou l'association adalimumab/méthotrexate qui ont été inclus dans l'étude d'extension en ouvert, 171 patients ont terminé 10 ans de traitement par adalimumab. Parmi ces patients, 109 patients (63,7 %) étaient en rémission à 10 ans.
Réponse radiographique
Dans l'étude III sur la PR, dans laquelle les patients traités par adalimumab avaient une polyarthrite rhumatoïde d'une durée moyenne de 11 ans environ, les dommages structuraux articulaires ont été évalués par radiographie et exprimés en termes de modification du score total de Sharp (STS) et de ses composants, le score d'érosion et le score de pincement articulaire. Les patients traités par adalimumab associé au méthotrexate ont présenté une progression significativement moindre que les patients recevant seulement du méthotrexate à 6 et 12 mois (voir tableau 10).
Dans l'extension en ouvert de l'étude III dans la PR, le ralentissement de la progression des dommages structuraux est maintenu à 8 et 10 ans pour une partie des patients. À 8 ans, 81 des 207 patients traités dès le début par 40 mg d'adalimumab toutes les deux semaines ont été évalués par radiographie. Parmi ces patients, 48 patients n'ont pas présenté de progression des dommages structuraux définie par une modification du score total de Sharp modifié de 0,5 ou moins par rapport à la valeur de base. À 10 ans, 79 des 207 patients traités dès le début par 40 mg d'adalimumab toutes les deux semaines ont été évalués par radiographie. Parmi ces patients, 40 patients n'ont pas présenté de progression des dommages structuraux définie par une modification du score total de Sharp modifié de 0,5 ou moins par rapport à la valeur de base.
Tableau 10.
Modifications radiographiques moyennes sur 12 mois dans l'étude III sur la PR
|
|
Placebo /MTXa |
Adalimumab/ MTX 40 mg toutes les deux semaines |
Placebo/MTX- Adalimumab/MTX (intervalle de confiance à 95 %b) |
Valeur de p |
|
Score total de Sharp |
2,7 |
0,1 |
2,6 (1,4 ; 3,8) |
< 0,001c |
|
Score d'érosion |
1,6 |
0,0 |
1,6 (0,9 ; 2,2) |
< 0,001 |
|
Score de pincement articulaire (JSN)d |
1,0 |
0,1 |
0,9 (0,3 ; 1,4) |
0,002 |
a méthotrexate
b intervalle de confiance à 95 % des différences de variations des scores entre méthotrexate et adalimumab.
c d'après les analyses de rang
d JSN = Joint Space Narrowing
b intervalle de confiance à 95 % des différences de variations des scores entre méthotrexate et adalimumab.
c d'après les analyses de rang
d JSN = Joint Space Narrowing
Dans l'étude V sur la PR, les dommages structuraux articulaires ont été évalués par radiographie et exprimés en termes de modification du score total de Sharp (voir tableau 11).
Tableau 11.
Valeurs moyennes des modifications radiographiques
à la semaine 52 dans l'étude V sur la PR
|
|
MTX n = 257 (intervalle de confiance à 95 %) |
Adalimumab n = 274 (intervalle de confiance à 95 %) |
Adalimumab/ MTX n = 268 (intervalle de confiance à |
Valeur de pa |
Valeur de pb |
Valeur de pc |
|
Score total de Sharp |
5,7 (4,2 - 7,3) |
3,0 (1,7 - 4,3) |
1,3 (0,5 - 2,1) |
< 0,001 |
0,0020 |
< 0,001 |
|
Score |
3,7 |
1,7 (1,0 - 2,4) |
0,8 (0,4 - 1,2) |
< 0,001 |
0,0082 |
< 0,001 |
|
Score de |
2,0 |
1,3 (0,5 - 2,1) |
0,5 (0 - 1,0) |
< 0,001 |
0,0037 |
0,151 |
a
La valeur
de p résulte de la comparaison appariée des traitements par méthotrexate
seul et par l'association adalimumab/méthotrexate par le test U de
Mann-Whitney.
b La valeur de p résulte de la comparaison appariée des traitements par adalimumab seul et par l'association adalimumab/méthotrexate par le test U de Mann-Whitneyc La valeur de p résulte de la comparaison appariée des traitements par adalimumab seul et par méthotrexate seul par le test U de Mann-Whitney
b La valeur de p résulte de la comparaison appariée des traitements par adalimumab seul et par l'association adalimumab/méthotrexate par le test U de Mann-Whitneyc La valeur de p résulte de la comparaison appariée des traitements par adalimumab seul et par méthotrexate seul par le test U de Mann-Whitney
À la suite de 52 et 104 semaines de traitement, le pourcentage de patients sans progression (modification du score total de Sharp modifié par rapport à la valeur de base ≤ 0,5) était significativement supérieur avec le traitement par l'association adalimumab/méthotrexate (respectivement 63,8 % et 61,2 %) comparativement au méthotrexate en monothérapie (respectivement 37,4 % et 33,5 %, p < 0,001) et à l'adalimumab en monothérapie (respectivement 50,7 %, p < 0,002 et 44,5 %, p < 0,001).
Dans la phase d'extension en ouvert de l'étude V sur la PR, la modification moyenne du score total de Sharp modifié à 10 ans par rapport à la valeur de base a été de 10,8 chez les patients randomisés initialement pour recevoir le méthotrexate en monothérapie, 9,2 chez les patients randomisés initialement pour recevoir l'adalimumab en monothérapie et 3,9 chez les patients randomisés initialement pour recevoir l'association adalimumab/méthotrexate. Les proportions correspondantes de patients ne présentant pas de progression radiographique ont été respectivement de 31,3 %, 23,7 % et 36,7 %.
Qualité de vie et capacités fonctionnelles
La qualité de vie en rapport avec la santé et la fonction physique ont été évaluées au moyen de l'indice d'invalidité du Questionnaire d'Evaluation de l'état de Santé (Health Assessment Questionnaire, HAQ) dans les quatre essais originels adéquats et correctement contrôlés et constituait un critère principal d'évaluation pré-spécifié à la 52e semaine dans l'étude III sur la PR. Comparativement au placebo, toutes les doses/schémas posologiques d'administration de l'adalimumab ont entraîné une amélioration statistiquement significative plus importante de l'indice d'invalidité du HAQ entre l'examen initial et le 6e mois dans les quatre études et il en a été de même à la semaine 52 dans l'étude III sur la PR. Dans les quatre études, les résultats des scores de la Short Form Health Survey (SF-36) confirment ces observations pour toutes les doses/schémas posologiques d'administration de l'adalimumab, avec des valeurs des composantes physiques (PCS) statistiquement significatives, ainsi que des scores de douleur et de vitalité statistiquement significatifs pour la dose de 40 mg toutes les deux semaines. Dans les trois études dans lesquelles elle a été prise en compte (études I, III et IV sur la PR), on a observé une diminution statistiquement significative de la fatigue mesurée à l'aide des scores d'évaluation fonctionnelle de traitement pour maladie chronique (FACIT).Dans l'étude III sur la PR, la plupart des patients ayant obtenu une amélioration des capacités fonctionnelles et ayant poursuivi le traitement ont maintenu cette amélioration jusqu'à la semaine 520 (120 mois) du traitement en ouvert. L'amélioration de la qualité de vie a été mesurée jusqu'à la semaine 156 (36 mois) et l'amélioration a été maintenue au cours de cette période.
Dans l'étude V sur la PR, l'amélioration de l'indice
d'invalidité HAQ et la composante physique du SF-36 s'est montrée beaucoup plus
importante (p < 0,001) pour l'association adalimumab/méthotrexate par rapport
à la monothérapie de méthotrexate et la monothérapie d'adalimumab à la semaine
52, et s'est maintenue jusqu'à la semaine 104. Parmi les 250 patients ayant
terminé l'étude d'extension en ouvert, l'amélioration des capacités
fonctionnelles s'est maintenue au cours des 10 ans de traitement.
Spondyloarthrite axiale
Spondylarthrite ankylosante (SA)
L'adalimumab à la dose de 40 mg toutes les deux semaines, a été évalué dans deux études randomisées, en double aveugle, contrôlées contre placebo, d'une durée de 24 semaines chez 393 patients atteints de spondylarthrite ankylosante active (la valeur moyenne initiale du score d'activité de la maladie [Bath Ankylosing Spondylitis Disease Activity Index (BASDAI)] était de 6,3 dans tous les groupes) qui n'avaient pas répondu de manière adéquate à un traitement conventionnel. Soixante-dix-neuf (20,1 %) patients étaient traités de manière concomitante par DMARDs et 37 (9,4 %) patients par des glucocorticoïdes. La période en aveugle a été suivie d'une période en ouvert pendant laquelle les patients recevaient 40 mg d'adalimumab toutes les deux semaines par voie souscutanée pendant 28 semaines supplémentaires. Les sujets (n = 215, 54,7 %) qui n'étaient pas répondeurs à l'ASAS 20 aux semaines 12, 16 ou 20, ont été traités prématurément en ouvert par 40 mg d'adalimumab toutes les deux semaines par voie sous-cutanée, et ont été ultérieurement considérés comme non-répondeurs dans les analyses statistiques de la phase en double aveugle.
Dans l'étude la plus importante (I) sur la SA comprenant 315 patients, les résultats ont montré une amélioration statistiquement significative des signes et symptômes de spondylarthrite ankylosante avec l'adalimumab comparé au placebo. La première réponse significative a été observée à la semaine 2 et s'est maintenue pendant 24 semaines (tableau 12).
Tableau 12.
Réponses d'efficacité de l'étude SA contrôlée
contre placebo - Étude I
Réduction des signes et symptômes
|
Réponse |
Placebo N = 107 |
Adalimumab N = 208 |
|
ASASa 20 |
|
|
|
Semaine 2 |
16 % |
42 %*** |
|
Semaine 12 |
21 % |
58 %*** |
|
Semaine 24 |
19 % |
51 %*** |
|
ASAS 50 |
|
|
|
Semaine 2 |
3 % |
16 %*** |
|
Semaine 12 |
10 % |
38 %*** |
|
Semaine 24 |
11 % |
35 %*** |
|
ASAS 70 |
|
|
|
Semaine 2 |
0 % |
7 %** |
|
Semaine 12 |
5 % |
23 %*** |
|
Semaine 24 |
8 % |
24 %*** |
|
BASDAIb 50 |
|
|
|
Semaine 2 |
4 % |
20 %*** |
|
Semaine 12 |
16 % |
45 %*** |
|
Semaine 24 |
15 % |
42 %*** |
***,** Statistiquement significatif à p < 0,001,
< 0,01 pour toutes les comparaisons entre l'adalimumab et le placebo aux
semaines 2, 12 et 24
a Evaluations de spondylarthrite ankylosante
b Bath Ankylosing Spondylitis Disease Activity Index
a Evaluations de spondylarthrite ankylosante
b Bath Ankylosing Spondylitis Disease Activity Index
Les patients traités par adalimumab avaient une amélioration significativement plus importante à la semaine 12 qui se maintenait jusqu'à la semaine 24 à la fois pour le SF36 et pour l'Ankylosing Spondylitis Quality of Life Questionnaire (ASQoL).
Des résultats tendant à être comparables (pas tous statistiquement significatifs) ont été observés dans une étude sur la SA moins importante, randomisée, en double aveugle, contrôlée contre placebo (II) de 82 patients adultes atteints d'une spondylarthrite ankylosante active.
Spondyloarthrite axiale sans signes radiographiques de SA
La tolérance et l'efficacité de l'adalimumab ont été évaluées dans deux études randomisées, en double aveugle, contrôlées contre placebo menées chez des patients atteints de spondyloarthrite axiale non radiographique (nr-axSpA). L'étude nr-axSpA I a évalué des patients atteints de nr-axSpA active. L'étude nr-axSpA II était une étude d'arrêt du traitement chez des patients atteints de nr-axSpA active ayant obtenu une rémission au cours d'un traitement en ouvert par adalimumab.
Étude nr-axSpA I
Dans l'étude nr-axSpA I, l'adalimumab administré à la dose de 40 mg toutes les deux semaines a été évalué dans une étude randomisée, en double aveugle, contrôlée contre placebo d'une durée de 12 semaines menée chez 185 patients atteints de nr-axSpA active (le score initial moyen d'activité de la maladie [Bath Ankylosing Spondylitis Disease Activity Index (BASDAI)] était de 6,4 chez les patients traités par adalimumab et de 6,5 chez les patients du groupe placebo) qui avaient présenté une réponse inadéquate ou une intolérance à au moins 1 AINS ou une contre-indication aux AINS.
À l'inclusion dans l'étude, 33 patients (18 %) étaient traités de façon concomitante par des DMARDs et 146 patients (79 %) par des AINS. La période en double aveugle a été suivie d'une période en ouvert au cours de laquelle les patients ont reçu l'adalimumab 40 mg toutes les deux semaines par voie sous-cutanée pendant 144 semaines supplémentaires. Les résultats à la semaine 12 ont montré une amélioration statistiquement significative des signes et symptômes de nr-axSpA active chez les patients traités par adalimumab comparativement au placebo (tableau 13).
Tableau 13.
Réponse d'efficacité dans l'étude nr-axSpA I
contrôlée contre placebo
|
Double aveugle Réponse à la semaine 12 |
Placebo N = 94 |
Adalimumab N = 91 |
|
ASASa 40 |
15 % |
36 %*** |
|
ASAS 20 |
31 % |
52 %** |
|
ASAS 5/6 |
6 % |
31 %*** |
|
ASAS Rémission partielle |
5 % |
16 %* |
|
BASDAIb 50 |
15 % |
35 %** |
|
ASDASc,d,e |
-0,3 |
-1,0 |
|
ASDAS Maladie inactive |
4 % |
24 %*** |
|
hs-CRPd,f,g |
-0,3 |
-4,7*** |
|
SPARCCh IRM des articulations sacroiliaquesd,i |
-0,6 |
-3,2** |
|
SPARCC IRM du rachisd,j |
-0,2 |
-1,8** |
a Assessment of Spondyloarthritis International Society
b Bath Ankylosing Spondylitis Disease Activity Index
c Ankylosing Spondylitis Disease Activity Score
d Variation moyenne par rapport à la valeur initiale
e n = 91 placebo et n = 87 adalimumab
f Protéine C-réactive ultrasensible (mg/l)
g n = 73 placebo et n = 70 adalimumab
h Spondyloarthritis Research Consortium of Canada
i n = 84 placebo et adalimumab
j n = 82 placebo et n = 85 adalimumab
***, **, * Résultat statistiquement significatif à p < 0,001, < 0,01 et < 0,05 respectivement pour toutes les comparaisons entre l'adalimumab et le placebo.
b Bath Ankylosing Spondylitis Disease Activity Index
c Ankylosing Spondylitis Disease Activity Score
d Variation moyenne par rapport à la valeur initiale
e n = 91 placebo et n = 87 adalimumab
f Protéine C-réactive ultrasensible (mg/l)
g n = 73 placebo et n = 70 adalimumab
h Spondyloarthritis Research Consortium of Canada
i n = 84 placebo et adalimumab
j n = 82 placebo et n = 85 adalimumab
***, **, * Résultat statistiquement significatif à p < 0,001, < 0,01 et < 0,05 respectivement pour toutes les comparaisons entre l'adalimumab et le placebo.
Dans l'étude d'extension en ouvert, l'amélioration des signes et symptômes s'est maintenue avec le traitement par adalimumab jusqu'à la semaine 156.
Inhibition de l'inflammation
Une amélioration significative des signes d'inflammation telle que mesurée par les taux de hs-CRP et l'IRM des articulations sacro-iliaques et du rachis s'est maintenue chez les patients traités par adalimumab jusqu'à la semaine 156 et la semaine 104, respectivement.
Qualité de vie et capacités fonctionnelles
La qualité de vie liée à la santé et la fonction physique ont été évaluées à l'aide des questionnaires HAQ-S et SF-36. Les patients traités par adalimumab ont présenté une amélioration significativement supérieure du score HAQ-S total et du score de la composante physique (PCS) du questionnaire SF-36 de l'inclusion à la semaine 12 par rapport au placebo. Une amélioration de la qualité de vie liée à la santé et la fonction physique s'est maintenue au cours de l'étude d'extension en ouvert jusqu'à la semaine 156.
Étude nr-axSpA II
673 patients atteints de nr-axSpA active (le score initial moyen d'activité de la maladie [BASDAI] était de 7,0) qui avaient présenté une réponse insuffisante à ≥ 2 AINS ou une intolérance ou une contre-indication aux AINS ont été inclus dans la période en ouvert de l'étude nr-axSpA II au cours de laquelle ils ont reçu l'adalimumab 40 mg toutes les deux semaines pendant 28 semaines.
Ces patients présentaient également des signes objectifs d'inflammation à l'IRM des articulations sacro-iliaques ou du rachis ou un taux élevé de hs-CRP. Les patients ayant obtenu une rémission prolongée pendant au moins 12 semaines (N = 305) (ASDAS < 1,3 aux semaines 16, 20, 24 et 28) au cours de la période en ouvert, ont ensuite été randomisés soit pour poursuivre le traitement par adalimumab 40 mg toutes les deux semaines (N = 152) soit pour recevoir un placebo (N = 153) pendant 40 semaines supplémentaires dans le cadre d'une période en double aveugle, contrôlée contre placebo (durée totale de l'étude : 68 semaines). Les patients présentant une poussée de la maladie au cours de la période en double aveugle étaient autorisés à recevoir un traitement de secours par adalimumab 40 mg toutes les deux semaines pendant au moins 12 semaines.
Le critère d'évaluation principal de l'efficacité était le pourcentage de patients sans poussée à la semaine 68 de l'étude. Une poussée était définie comme un score ASDAS ≥ 2,1 lors de deux visites consécutives séparées de quatre semaines. Une proportion plus importante de patients sous adalimumab n'a pas présenté de poussée de la maladie au cours de la période en double aveugle versus placebo (70,4 % versus 47,1 %, p < 0,001) (figure 1).
Figure 1. Courbes de Kaplan-Meier illustrant le délai jusqu'à une poussée de la maladie dans l'étude nr-axSpA II
Remarque : P = Placebo (Nombre de patients à risque (Nombre de poussées)) ; A = Adalimumab (Nombre de patients à risque (Nombre de poussées)).
Parmi les 68 patients avec des poussées dans le groupe qui a arrêté le traitement, 65 ont reçu 12 semaines de traitement de secours par adalimumab, parmi lesquels 37 (56,9 %) ont de nouveau obtenu une rémission (ASDAS < 1,3) 12 semaines après avoir repris le traitement en ouvert.
À la semaine 68, les patients recevant un traitement continu par adalimumab ont montré une amélioration statistiquement significative des signes et symptômes de la nr-axSpA active versus les patients qui ont arrêté le traitement pendant la période en double aveugle de l'étude (tableau 14).
Tableau 14.
Réponse d'efficacité dans la période contrôlée
contre placebo de l'étude nr-axSpA II
|
Double aveugle Réponse à la semaine 68 |
Placebo N = 153 |
Adalimumab N = 152 |
|
ASASa,b 20 |
47,1 % |
70,4 %*** |
|
ASASa,b 40 |
45,8 % |
65,8 %*** |
|
ASASa Rémission Partielle |
26,8 % |
42,1 %** |
|
ASDASc Maladie inactive |
33,3 % |
57,2 %*** |
|
Poussée partielled |
64,1 % |
40,8 %*** |
a
Assessment
of Spondyloarthritis International Society
b L'inclusion est définie comme l'inclusion dans la période en ouvert lorsque les patients ont une maladie active.
c Ankylosing Spondylitis Disease Activity Score d Une poussée partielle est définie comme un score ASDAS ≥ 1,3 mais < 2,1 lors de 2 visites consécutives.
***, ** Résultat statistiquement significatif à p < 0,001 et < 0,01 respectivement pour toutes les comparaisons entre l'adalimumab et le placebo.
b L'inclusion est définie comme l'inclusion dans la période en ouvert lorsque les patients ont une maladie active.
c Ankylosing Spondylitis Disease Activity Score d Une poussée partielle est définie comme un score ASDAS ≥ 1,3 mais < 2,1 lors de 2 visites consécutives.
***, ** Résultat statistiquement significatif à p < 0,001 et < 0,01 respectivement pour toutes les comparaisons entre l'adalimumab et le placebo.
Rhumatisme psoriasique
L'adalimumab, 40 mg toutes les deux semaines, a été étudié chez des patients ayant un rhumatisme psoriasique (RPs) active modérée à sévère dans deux études contrôlées contre placebo, les études I et II sur le RPs. Dans l'étude I sur le RPs d'une durée de 24 semaines, on a traité 313 patients adultes qui avaient une réponse inadéquate à un traitement par anti-inflammatoire non stéroïdien, et parmi lesquels environ 50 % prenaient du méthotrexate. Dans l'étude II sur le RPs d'une durée de 12 semaines, 100 patients qui présentaient une réponse inadéquate à un traitement de fond, ont été traités. À la fin des 2 études, 383 patients ont été recrutés dans une étude d'extension en ouvert, au cours de laquelle ils ont reçu 40 mg d'adalimumab toutes les deux semaines.
En raison du petit nombre de patients étudiés les preuves de l'efficacité de l'adalimumab, chez les patients atteints d'arthrite psoriasique à type de spondylarthrite ankylosante, sont insuffisantes.
Tableau 15.
Réponse ACR des études contrôlées contre placebo,
dans le rhumatisme psoriasique(pourcentage de patients)
|
|
Étude I sur le RPs |
Étude II sur le RPs |
||
|
Réponse |
Placebo N = 162 |
Adalimumab N = 151 |
Placebo N = 49 |
Adalimumab N = 51 |
|
ACR 20 |
|
|
|
|
|
Semaine 12 |
14 % |
58 %*** |
16 % |
39 %* |
|
Semaine 24 |
15 % |
57 %*** |
N/A |
N/A |
|
ACR 50 |
|
|
|
|
|
Semaine 12 |
4 % |
36 %*** |
2 % |
25 %*** |
|
Semaine 24 |
6 % |
39 %*** |
N/A |
N/A |
|
ACR 70 |
|
|
|
|
|
Semaine 12 |
1 % |
20 %*** |
0 % |
14 %* |
|
Semaine 24 |
1 % |
23 %*** |
N/A |
N/A |
*** p < 0,001 pour toutes comparaisons entre
l'adalimumab et le placebo
* p < 0,05 pour toutes comparaisons entre l'adalimumab et le placebo
N/A non applicable
* p < 0,05 pour toutes comparaisons entre l'adalimumab et le placebo
N/A non applicable
Les réponses ACR dans l'étude I sur le RPs étaient identiques avec ou sans traitement concomitant par le méthotrexate. Les réponses ACR se sont maintenues jusqu'à 136 semaines au cours de l'étude d'extension en ouvert.
Les modifications radiographiques ont été évaluées lors des études du rhumatisme psoriasique. Des images radiographiques des mains, des poignets et des pieds ont été obtenues au début de l'étude puis au cours de la semaine 24 de la phase en double insu, au cours de laquelle les patients étaient sous adalimumab ou sous placebo, et de la semaine 48, lorsque tous les patients recevaient l'adalimumab en ouvert. Un score total de Sharp modifié (modified Total Sharp Score, mTSS), incluant les articulations inter-phalangiennes distales (c'est-à-dire une mesure différente par rapport au TSS utilisé dans les études de la polyarthrite rhumatoïde) a été utilisé.
Comparativement au placebo, l'adalimumab a ralenti la vitesse de progression des atteintes articulaires périphériques, mesurée par les modifications du mTSS (moyenne ± ET) 0,8 ± 2,5 dans le groupe placebo (à la semaine 24) contre 0,0 ± 1,9 ; (p< 0,001) dans le groupe adalimumab (à la semaine 48).
Chez 84 % des 102 patients traités par adalimumab et ne présentant pas de progression radiographique entre le début de l'étude et la semaine 48, cette absence de progression radiographique s'est poursuivie jusqu'au terme des 144 semaines de traitement. Comparativement au placebo, les patients sous adalimumab ont montré une amélioration statistiquement significative des capacités fonctionnelles évaluées par le HAQ et la Short Form Health Survey (SF-36) au bout de 24 semaines. Cette amélioration des capacités fonctionnelles s'est maintenue jusqu'à la semaine 136 de l'étude d'extension en ouvert.
Psoriasis
L'efficacité et la tolérance de l'adalimumab ont été étudiées lors d'études randomisées menées en double aveugle chez des patients adultes atteints de psoriasis en plaques chronique (intéressant ≥ 10 % de la surface corporelle, avec un indice de sévérité PASI (Psoriasis Area and Severity Index) ≥ 12 ou ≥ 10) qui étaient candidats à un traitement systémique ou une photothérapie. Au total, 73 % des patients recrutés dans les études I et II sur le psoriasis avaient déjà reçu un traitement systémique ou une photothérapie. L'efficacité et la sécurité de l'adalimumab ont également été étudiées chez des patients adultes atteints de psoriasis en plaques chronique modéré à sévère avec une atteinte concomitante des mains et/ou des pieds qui étaient candidats à un traitement systémique dans une étude randomisée en double aveugle (étude III sur le psoriasis).
L'étude I sur le psoriasis (REVEAL) a porté sur 1 212 patients pendant trois périodes de traitement. Durant la période A, les patients recevaient un placebo ou l'adalimumab à la dose initiale de 80 mg, suivie de 40 mg toutes les deux semaines à partir d'une semaine après la dose initiale. Au bout de 16 semaines de traitement, les patients ayant obtenu au minimum une réponse PASI 75 (amélioration d'au moins 75 % du score PASI par rapport aux valeurs initiales), entraient dans la période B et recevaient 40 mg d'adalimumab en ouvert toutes les deux semaines. Les patients dont la réponse restait ≥ PASI 75 à la semaine 33 et qui avaient été initialement randomisés pour recevoir le traitement actif pendant la période A, ont à nouveau été randomisés pendant la période C pour recevoir 40 mg d'adalimumab toutes les deux semaines ou un placebo pendant 19 semaines supplémentaires. Dans tous les groupes de traitement, le score PASI initial moyen était de 18,9 et le score PGA (Physician's Global Assessment, évaluation initiale globale du médecin) était compris entre « modéré » (53 % des sujets inclus) et « sévère » (41 %), voire « très sévère » (6 %).
L'étude II sur le psoriasis (CHAMPION) a comparé l'efficacité et la tolérance de l'adalimumab à celles du méthotrexate et d'un placebo chez 271 patients. Les patients ont reçu un placebo, une dose initiale de MTX à 7,5 mg, augmentée ensuite jusqu'à la semaine 12, la dose maximale étant de 25 mg, ou bien une dose initiale de 80 mg d'adalimumab suivie de 40 mg toutes les deux semaines (en commençant une semaine après la semaine initiale) pendant 16 semaines. On ne dispose d'aucune donnée concernant la comparaison entre l'adalimumab et le MTX au-delà de 16 semaines de traitement. Chez les patients sous MTX ayant atteint une réponse ≥ PASI 50 à la semaine 8 et/ou 12, la posologie n'était pas augmentée davantage. Dans tous les groupes de traitement, le score PASI initial moyen était de 19,7 et le score PGA initial allait de « léger » (< 1 %) à « modéré » (48 %), « sévère » (46 %) et « très sévère » (6 %).
Les patients ayant participé aux études de phase 2 et de phase 3 dans le psoriasis étaient éligibles pour entrer dans une étude d'extension en ouvert, dans laquelle l'adalimumab était administré pendant au moins 108 semaines supplémentaires.
L'un des principaux critères d'évaluation des études I et II sur le psoriasis était le pourcentage de patients ayant atteint une réponse PASI 75 entre l'inclusion et la semaine 16 (voir tableaux 16 et 17).
Tableau 16.
Étude I sur le psoriasis (REVEAL) — Résultats
d'efficacité à 16 semaines
|
|
Placebo N = 398 n (%) |
Adalimumab 40 mg toutes les deux semaines N = 814 n (%) |
|
≥ PASI 75a |
26 (6,5) |
578 (70,9)b |
|
PASI 100 | 3 (0,8) |
163 (20,0)b |
|
PGA : clair/minimal | 17 (4,3) |
506 (62,2)b |
a
Le
pourcentage de patients atteignant une réponse PASI 75 a été calculé comme un
taux ajusté en fonction du centre d'étude
b p < 0,001, adalimumab versus placebo
b p < 0,001, adalimumab versus placebo
Tableau 17.
Étude II sur le psoriasis (CHAMPION) — Résultats d'efficacité à 16 semaines
|
|
Placebo N = 53 n (%) |
MTX N = 110 n (%) |
Adalimumab 40 mg toutes les deux semaines N = 108 n (%) |
|
≥ PASI 75 |
10 (18,9) |
39 (35,5) |
86 (79,6)a,b |
|
PASI 100 |
1 (1,9) |
8 (7,3) |
18 (16,7)c,d |
|
PGA : clair/minimal |
6 (11,3) |
33 (30,0) |
79 (73,1)a,b |
a p < 0,001 adalimumab vs. placebo
b p < 0,001 adalimumab vs. méthotrexate
c p < 0,01 adalimumab vs. placebo
d p < 0,05 adalimumab vs. méthotrexate
b p < 0,001 adalimumab vs. méthotrexate
c p < 0,01 adalimumab vs. placebo
d p < 0,05 adalimumab vs. méthotrexate
Dans l'étude I sur le psoriasis, 28 % des patients ayant présenté une réponse PASI 75 et randomisés à nouveau pour recevoir le placebo à la semaine 33 et 5 % de ceux poursuivant le traitement par adalimumab (p< 0,001), ont présenté « une diminution de la réponse appropriée » (score PASI entre la semaine 33 et la semaine 52 (incluse) se traduisant par une réponse < PASI 50 par rapport à l'inclusion, avec un minimum d'augmentation de 6 points du score PASI par rapport à la semaine 33). Parmi les patients présentant une diminution de la réponse appropriée après la re-randomisation dans le groupe placebo et ensuite recrutés dans l'étude d'extension en ouvert, 38 % (25/66) et 55 % (36/66) ont retrouvé une réponse PASI 75 au bout de respectivement 12 et 24 semaines.
Un total de 233 patients répondeurs PASI 75 à la semaine 16 et à la semaine 33 ont reçu un traitement en continu par adalimumab pendant 52 semaines dans l'étude I et ont poursuivi le traitement par adalimumab dans l'étude d'extension en ouvert. Le taux de réponse PASI 75 et PGA clair ou minimal chez ces patients étaient respectivement de 74,7 % et 59,0 %, après 108 semaines supplémentaires de traitement en ouvert (total de 160 semaines). Dans une analyse où tous les patients sortis d'essai pour effets indésirables ou pour manque d'efficacité ou pour lesquels la dose a été augmentée, ont été considérés comme non-répondeurs, le taux de réponse PASI 75 et PGA clair ou minimal chez ces patients étaient respectivement de 69,6 % et 55,7 %, après 108 semaines supplémentaires de traitement en ouvert (total de 160 semaines).
Un total de 347 patients répondeurs stables ont participé à une évaluation d'interruption de traitement et de retraitement dans une étude d'extension en ouvert. Durant la période d'interruption de traitement, les symptômes du psoriasis sont réapparus au cours du temps avec un délai médian de rechute (régression vers un PGA « modéré » ou plus sévère) d'environ 5 mois. Aucun patient n'a présenté de rebond durant la phase d'interruption de traitement. 76,5 % (218/285) des patients qui sont entrés dans la période de retraitement ont eu une réponse PGA « clair » ou « minimal » après 16 semaines de retraitement, indépendamment du fait qu'ils aient rechuté ou non durant l'interruption de traitement (69,1 % [123/178] pour les patients qui ont rechuté durant la période d'interruption et 88,8 % [95/107] pour les patients qui n'ont pas rechuté durant la période d'interruption). Un profil de tolérance similaire a été observé durant le retraitement et avant l'interruption de traitement.
L'index dermatologique de qualité de vie DLQI (Dermatology Life Quality Index) a mis en évidence des améliorations significatives à la semaine 16 par rapport à l'inclusion, comparativement au placebo (études I et II) et au MTX (étude II). Dans l'étude I, les améliorations des scores résumés des composantes physiques et psychologiques du SF-36 étaient également significatives par rapport au placebo.
Dans une étude d'extension en ouvert chez les patients ayant dû augmenter les doses (de 40 mg toutes les deux semaines à 40 mg toutes les semaines) en raison d'une réponse PASI inférieure à 50 %, 26,4 % (92/349) et 37,8 % (132/349) des patients ont atteint une réponse PASI 75 à la semaine 12 et à la semaine 24, respectivement.
L'étude III dans le psoriasis (REACH) a comparé l'efficacité et la tolérance de l'adalimumab versus placebo chez 72 patients présentant un psoriasis en plaques chronique modéré à sévère avec une atteinte concomitante des mains et/ou des pieds. Les patients ont reçu une dose initiale de 80 mg d'adalimumab suivi par 40 mg toutes les deux semaines (en commençant une semaine après la dose initiale) ou le placebo pendant 16 semaines. À la semaine 16, une proportion statistiquement significative plus importante de patients ayant reçu l'adalimumab ont atteint un PGA « clair » ou « pratiquement clair » pour les mains et/ou les pieds par rapport à ceux qui ont reçu le placebo (30,6 % versus 4,3 %, respectivement [p = 0,014]).
L'étude IV dans le psoriasis a comparé l'efficacité et la tolérance de l'adalimumab versus placebo chez 217 patients adultes atteints de psoriasis unguéal modéré à sévère. Les patients ont reçu une dose initiale de 80 mg d'adalimumab, suivie par 40 mg toutes les deux semaines (en commençant une semaine après la dose initiale) ou un placebo pendant 26 semaines suivi d'un traitement par adalimumab en ouvert pendant 26 semaines supplémentaires. L'évaluation du psoriasis unguéal a été faite sur la base de l'indice modifié de sévérité du psoriasis unguéal (mNAPSI, Modified Nail Psoriasis Severity Index), de l'évaluation globale par le médecin de la sévérité du psoriasis des ongles des mains (PGA-F, Physician's Global Assessment of Fingernail Psoriasis) et de l'indice de sévérité du psoriasis unguéal (NAPSI, Nail Psoriasis Severity Index) (voir Tableau 18). L'adalimumab a démontré un bénéfice dans le traitement des patients atteints de psoriasis unguéal présentant différents degrés d'atteinte cutanée (Surface Corporelle Atteinte SCA≥ 10 % [60 % des patients] et SCA< 10 % et ≥ 5 % [40 % des patients]).
Tableau 18.
Étude IV sur le psoriasis — Résultats d'efficacité
à 16, 26 et 52 semaines
|
Critères |
Semaine 16 Phase contrôlée versus placebo |
Semaine 26 Phase contrôlée versus placebo |
Semaine 52 Phase en ouvert |
||
|
Placebo N = 108 |
Adalimumab 40 mg toutes les deux semaines N = 109 |
Placebo N = 108 |
Adalimumab 40 mg toutes les deux semaines N = 109 |
Adalimumab 40 mg toutes les deux semaines N = 80 |
|
|
≥ mNAPSI 75 (%) |
2,9 |
26,0a |
3,4 |
46,6a |
65,0 |
|
PGA-F clair/minimal et ≥ 2-grade d'amélioration (%) |
2,9 |
29,7a |
6,9 |
48,9a |
61,3 |
|
Pourcentage de variation du NAPSI des ongles des mains total (%) |
-7,8 |
-44,2a |
-11,5 |
-56,2a |
-72,2 |
a p < 0,001 adalimumab vs. placebo
Les patients traités par adalimumab ont montré des améliorations statistiquement significatives du DLQI à la semaine 26 par rapport au groupe placebo.
Hidrosadénite suppurée
La tolérance et l'efficacité d'adalimumab ont été évaluées au cours d'études randomisées, en doubleaveugle, contrôlées contre placebo et d'une étude d'extension en ouvert chez des patients adultes atteints d'hidrosadénite suppurée (HS) modérée à sévère ayant présenté une intolérance, une contreindication ou une réponse insuffisante à un traitement antibiotique systémique de 3 mois minimum. Les patients des études HS-I et HS-II présentaient une maladie de stade II ou III selon la classification de Hurley, avec au moins 3 abcès ou nodules inflammatoires.
L'étude HS-I (PIONEER I) a évalué 307 patients sur 2 périodes de traitement. Au cours de la période A, les patients recevaient le placebo ou l'adalimumab à une dose initiale de 160 mg à la semaine 0, puis 80 mg à la semaine 2, et 40 mg toutes les semaines de la semaine 4 à la semaine 11. L'utilisation concomitante d'antibiotiques n'était pas autorisée au cours de l'étude. Après 12 semaines de traitement, les patients traités par adalimumab au cours de la période A ont été de nouveau randomisés dans la période B dans l'un des 3 groupes de traitement (adalimumab 40 mg toutes les semaines, adalimumab 40 mg toutes les deux semaines, ou placebo de la semaine 12 à la semaine 35). Les patients randomisés pour recevoir le placebo au cours de la période A ont été affectés au groupe adalimumab 40 mg toutes les semaines de la période B.
L'étude HS-II (PIONEER II) a évalué 326 patients sur 2 périodes de traitement. Au cours de la période A, les patients recevaient le placebo ou l'adalimumab à une dose initiale de 160 mg à la semaine 0, puis 80 mg à la semaine 2, et 40 mg toutes les semaines de la semaine 4 à la semaine 11. 19,3 % des patients ont poursuivi pendant la durée de l'étude le traitement antibiotique oral qu'ils avaient à l'inclusion. Après 12 semaines de traitement, les patients traités par adalimumab au cours de la période A ont été de nouveau randomisés dans la période B dans l'un des 3 groupes de traitement (adalimumab 40 mg toutes les semaines, adalimumab 40 mg toutes les deux semaines, ou placebo de la semaine 12 à la semaine 35). Les patients randomisés pour recevoir le placebo au cours de la période A ont été affectés au groupe placebo de la période B.
Les patients des études HS-I et HS-II étaient éligibles à l'inclusion dans une étude d'extension en ouvert au cours de laquelle l'adalimumab 40 mg était administré toutes les semaines. L'exposition moyenne dans toute la population traitée par adalimumab a été de 762 jours. Tout au long des 3 études, les patients ont utilisé quotidiennement un antiseptique local sur leurs lésions.
Réponse clinique
La réduction des lésions inflammatoires et la prévention de l'aggravation des abcès et des fistules drainantes ont été évaluées à l'aide du score de réponse clinique dans l'hidrosadénite suppurée (Hidradenitis Suppurativa Clinical Response, HiSCR : réduction d'au-moins 50 % du nombre total d'abcès et de nodules inflammatoires sans augmentation du nombre d'abcès ni du nombre de fistules drainantes par rapport aux valeurs à l'inclusion). La réduction de la douleur cutanée liée à l'HS a été évaluée à l'aide d'une échelle numérique chez les patients de l'étude qui présentaient à l'inclusion un score initial supérieur ou égal à 3 sur une échelle de 11 points.
À la semaine 12, il y a eu significativement plus de répondeurs HiSCR dans le groupe adalimumab comparativement au groupe placebo. À la semaine 12 de l'étude HS-II, un pourcentage significativement plus élevé de patients a obtenu une réduction cliniquement significative de la douleur liée à l'HS (voir tableau 19). Les patients traités par adalimumab présentaient une réduction significative du risque de poussée de la maladie au cours des 12 premières semaines de traitement.
Tableau 19.
Résultats d'efficacité à 12 semaines, études HS-I
et HS-II
|
|
Étude HS-I |
|
Étude HS-II |
|
|
Placebo |
Adalimumab 40 mg par semaine |
Placebo |
Adalimumab 40 mg par semaine |
|
|
HiSCRa |
N = 154 40 (26,0 %) |
N = 153 64 (41,8 %)* |
N = 163 45 (27,6 %) |
N = 163 96 (58,9 %)*** |
|
Réduction ≥ 30 % de la douleur cutanéeb |
N = 109 27 (24,8 %) |
N = 122 34 (27,9 %) |
N = 111 23 (20,7 %) |
N = 105 48 (45,7 %)*** |
* P < 0,05, *** P < 0,001, adalimumab
versus placebo
a Chez tous les patients randomisés.
b Chez les patients présentant un score de la douleur cutanée liée à l'HS à l'inclusion ≥ 3, sur la base d'une échelle numérique de 0 à 10, avec 0 = aucune douleur cutanée, 10 = pire douleur cutanée imaginable.
a Chez tous les patients randomisés.
b Chez les patients présentant un score de la douleur cutanée liée à l'HS à l'inclusion ≥ 3, sur la base d'une échelle numérique de 0 à 10, avec 0 = aucune douleur cutanée, 10 = pire douleur cutanée imaginable.
Le traitement par adalimumab 40 mg toutes les semaines a réduit significativement le risque d'aggravation des abcès et fistules drainantes. Au cours des 12 premières semaines des études HS-I et HS-II, environ deux fois plus de patients du groupe placebo ont présenté une aggravation des abcès (23,0 % versus 11,4 %, respectivement) et des fistules drainantes (30,0 % versus 13,9 %, respectivement), comparativement aux groupes adalimumab.
Comparé au placebo, des améliorations plus importantes entre l'inclusion et la semaine 12 ont été observées en termes de qualité de vie liée à la santé spécifique à la peau mesurée par l'indice de qualité de vie dermatologique (DLQI ; études HS-I et HS-II), de satisfaction globale du patient par rapport à son traitement médicamenteux mesurée par le questionnaire de satisfaction relative au traitement médicamenteux (Treatment Satisfaction Questionnaire -medication, TSQM ; études HS-I et HS-II), et de santé physique mesurée par la composante physique du score SF-36 (étude HS-I).
Chez les patients présentant au moins une réponse partielle à la semaine 12, traités par adalimumab 40 mg administré toutes les semaines, le taux HiSCR à la semaine 36 était plus élevé chez les patients recevant l'adalimumab toutes les semaines par rapport aux patients chez lesquels la fréquence d'administration était réduite à toutes les deux semaines ou chez lesquels le traitement était interrompu (voir tableau 20).
Tableau 20.
Pourcentage de patientsa répondeurs
HiSCRb aux semaines 24 et 36 après re-randomisation des traitements
à la semaine 12, patients issus du groupe adalimumab 40 mg par semaine
|
|
Placebo (arrêt du traitement) N = 73 |
Adalimumab 40 mg toutes les deux semaines N = 70 |
Adalimumab 40 mg par semaine N = 70 |
|
Semaine 24 |
24 (32,9 %) |
36 (51,4 %) |
40 (57,1 %) |
|
Semaine 36 |
22 (30,1 %) |
28 (40,0 %) |
39 (55,7 %) |
a
Patients
ayant présenté au moins une réponse partielle au traitement par adalimumab 40
mg par semaine après 12 semaines.
b Les patients répondant aux critères spécifiés dans le protocole en termes de perte de réponse ou d'absence d'amélioration devaient sortir de l'étude et étaient comptabilisés comme non-répondeurs.
b Les patients répondant aux critères spécifiés dans le protocole en termes de perte de réponse ou d'absence d'amélioration devaient sortir de l'étude et étaient comptabilisés comme non-répondeurs.
Parmi les patients présentant au moins une réponse partielle à la semaine 12 et traités en continu par adalimumab toutes les semaines, le taux de répondeurs HiSCR à la semaine 48 était de 68,3 % et de 65,1 % à la semaine 96. Un traitement à plus long terme par adalimumab 40 mg une fois par semaine pendant 96 semaines n'a identifié aucun nouveau signal de tolérance.
Parmi les patients dont le traitement par adalimumab a été interrompu à la semaine 12 dans les études HS-I et HS-II, le taux de répondeurs HiSCR 12 semaines après la ré-introduction de l'adalimumab 40 mg toutes les semaines était revenu à des valeurs similaires à celles observées avant l'interruption du traitement (56,0 %).
Maladie de Crohn
La tolérance et l'efficacité de l'adalimumab ont été évaluées chez plus de 1 500 patients ayant une maladie de Crohn active modérée à sévère (indice d'activité de la maladie de Crohn [Crohn's Disease Activity Index (CDAI)] ≥ 220 et ≤ 450) dans des études randomisées, en double-aveugle, contrôlées contre placebo. Des doses stables concomitantes d'aminosalicylés, de corticoïdes et/ou d'immunomodulateurs étaient autorisées et 80 % des patients ont continué à recevoir au moins un de ces médicaments.
L'induction d'une rémission clinique (définie par un indice CDAI < 150) a été évaluée dans deux études, l'étude I sur la MC (CLASSIC I) et l'étude II sur la MC (GAIN). Dans l'étude I sur la MC, 299 patients non précédemment traités par un antagoniste du TNF ont été randomisés vers l'un des quatre groupes de traitement de l'étude ; placebo aux semaines 0 et 2, 160 mg d'adalimumab à la semaine 0 et 80 mg à la semaine 2, 80 mg à la semaine 0 et 40 mg à la semaine 2, et 40 mg à la semaine 0 et 20 mg à la semaine 2. Dans l'étude II sur la MC, 325 patients ne répondant plus ou étant intolérants à l'infliximab ont été randomisés pour recevoir soit 160 mg d'adalimumab à la semaine 0 et 80 mg à la semaine 2 soit un placebo aux semaines 0 et 2. Les non-répondeurs primaires ont été exclus des études et ces patients n'ont par conséquent pas fait l'objet d'autres évaluations.
Le maintien de la rémission clinique a été évalué dans l'étude III sur la MC (CHARM). Dans l'étude III sur la MC, 854 patients ont reçu en ouvert 80 mg à la semaine 0 et 40 mg à la semaine 2. À la semaine 4, les patients ont été randomisés pour recevoir 40 mg toutes les deux semaines, 40 mg chaque semaine ou un placebo pour une durée totale de 56 semaines. Les patients présentant une réponse clinique (diminution de l'indice CDAI ≥ 70) à la semaine 4 ont été stratifiés et analysés séparément de ceux n'ayant pas présenté de réponse clinique à la semaine 4. La diminution progressive des corticoïdes était autorisée après la semaine 8.
Les taux d'induction d'une rémission et de réponse enregistrés dans les études I et II sur la MC sont présentés dans le tableau 21.
Tableau 21.
Induction d'une rémission clinique et d'une
réponse clinique (pourcentage de patients)
|
|
Étude I sur la MC : patients naïfs d'infliximab |
Étude II sur la MC : patients précédemment traités par l'infliximab |
|||
|
|
Placebo N = 74 |
Adalimumab 80/40 mg N = 75 |
Adalimumab 160/80 mg N = 76 |
Placebo N = 166 |
Adalimumab 160/80 mg N = 159 |
|
Semaine 4 |
|
|
|
|
|
|
Rémission clinique |
12 % |
24 % |
36 %* |
7 % |
21 %* |
|
Réponse clinique (CR-100) |
24 % |
37 % |
49 %** |
25 % |
38 %** |
Toutes les valeurs de p correspondent
à des comparaisons appariées des pourcentages pour l'adalimumab versus placebo
* p < 0,001
** p < 0,01
* p < 0,001
** p < 0,01
Des taux de rémission similaires ont été observés pour les schémas d'induction 160/80 mg et 80/40 mg à la semaine 8 et les événements indésirables ont été plus fréquents dans le groupe 160/80 mg.
Dans l'étude III sur la MC, 58 % (499/854) des patients présentaient une réponse clinique à la semaine 4 et ont été évalués dans l'analyse principale. Parmi les patients présentant une réponse clinique à la semaine 4, 48 % avaient été préalablement exposés à un autre traitement par antagoniste du TNF. Les taux de maintien de la rémission et de réponse sont présentés dans le tableau 22. Les résultats de rémission clinique sont restés relativement constants, indépendamment de l'exposition antérieure à un antagoniste du TNF.
Les hospitalisations et interventions chirurgicales liées à la maladie ont été réduites de manière statistiquement significative avec l'adalimumab comparé au placebo à la semaine 56.
Tableau 22.
Maintien de la rémission clinique et de la réponse
clinique (pourcentage de patients)
|
|
Placebo |
40 mg d'adalimumab toutes les deux semaines |
40 mg d'adalimumab toutes les semaines |
|
Semaine 26 |
N = 170 |
N = 172 |
N = 157 |
|
Rémission clinique |
17 % |
40 %* |
47 %* |
|
Réponse clinique (CR-100) |
27 % |
52 %* |
52 %* |
|
Patients en rémission sans corticoïdes depuis ≥ 90 joursa |
3 % (2/66) |
19 % (11/58)** |
15 % (11/74)** |
|
Semaine 56 |
N = 170 |
N = 172 |
N = 157 |
|
Rémission clinique |
12 % |
36 %* |
41 %* |
|
Réponse clinique (CR-100) |
17 % |
41 %* |
48 %* |
|
Patients en rémission sans corticoïdes depuis ≥ 90 joursa |
5 % (3/66) |
29 % (17/58)* |
20 % (15/74)** |
* p < 0,001 pour l'adalimumab versus placebo,
comparaisons appariées des pourcentages
** p < 0,02 pour l'adalimumab versus placebo, comparaisons appariées des pourcentages
a Parmi ceux initialement traités par corticoïdes
** p < 0,02 pour l'adalimumab versus placebo, comparaisons appariées des pourcentages
a Parmi ceux initialement traités par corticoïdes
Parmi les patients non répondeurs à la semaine 4, 43 % des patients recevant un traitement d'entretien par adalimumab ont répondu à la semaine 12 contre 30 % des patients recevant le placebo en traitement d'entretien. Ces résultats suggèrent que certains patients n'ayant pas répondu à la semaine 4 bénéficient de la poursuite du traitement d'entretien jusqu'à la semaine 12. La poursuite du traitement au-delà de 12 semaines n'est pas significativement associée à plus de réponses (voir rubrique Posologie et mode d'administration).
117/276 patients de l'étude I sur la MC et 272/777 patients des études II et III sur la MC ont été suivis pendant au moins 3 ans de traitement en ouvert par adalimumab. 88 et 189 patients, respectivement, sont restés en rémission clinique. La réponse clinique (CR-100) a été maintenue chez 102 et 233 patients, respectivement.
Qualité de vie
Dans les études I et II sur la MC, une amélioration statistiquement significative du score total du questionnaire sur les maladies inflammatoires de l'intestin (IBDQ) spécifique de la maladie a été obtenue à la semaine 4 chez les patients traités par adalimumab 80/40 mg et 160/80 mg versus placebo et également aux semaines 26 et 56 dans l'étude III sur la MC dans tous les groupes traités par adalimumab versus placebo.
Rectocolite hémorragique
La tolérance et l'efficacité de doses multiples d'adalimumab ont été évaluées chez des patients adultes atteints de rectocolite hémorragique active modérée à sévère (score Mayo de 6 à 12 avec un sous-score endoscopique de 2 à 3) dans des études randomisées, en double aveugle, contrôlées contre placebo.
Dans l'étude I sur la rectocolite hémorragique (RCH), 390 patients naïfs d'antagoniste du TNF ont été randomisés pour recevoir soit un placebo aux semaines 0 et 2, soit 160 mg d'adalimumab à la semaine 0 suivis de 80 mg à la semaine 2, soit 80 mg d'adalimumab à la semaine 0 suivis de 40 mg à la semaine 2. Après la semaine 2, les patients des deux groupes adalimumab ont reçu 40 mg toutes les deux semaines. La rémission clinique (définie par un score Mayo ≤ 2 sans aucun sous-score > 1) a été évaluée à la semaine 8.
Dans l'étude II sur la RCH, 248 patients ont reçu 160 mg d'adalimumab à la semaine 0, 80 mg à la semaine 2 puis 40 mg toutes les deux semaines et 246 patients ont reçu un placebo. Les résultats cliniques ont été évalués en termes d'induction d'une rémission à la semaine 8 et de maintien de la rémission à la semaine 52.
Les taux de rémission clinique versus placebo à la semaine 8 ont été significativement plus importants chez les patients ayant reçu un traitement d'induction par 160/80 mg d'adalimumab dans l'étude I sur la RCH (respectivement 18 % versus 9 %, p = 0,031) et dans l'étude II sur la RCH (respectivement 17 % versus 9 %, p = 0,019). Dans l'étude II sur la RCH, parmi les patients traités par adalimumab qui étaient en rémission à la semaine 8, 21/41 (51 %) étaient en rémission à la semaine 52.
Les résultats de l'ensemble de la population de l'étude II
sur la RCH sont présentés dans le tableau 23.
Tableau 23.
Réponse, rémission et cicatrisation de la muqueuse
dans l'étude II sur la RCH (pourcentage de patients)
|
|
Placebo |
Adalimumab 40 mg toutes les deux semaines |
|
Semaine 52 |
N = 246 |
N = 248 |
|
Réponse clinique |
18 % |
30 %* |
|
Rémission clinique |
9 % |
17 %* |
|
Cicatrisation de la muqueuse |
15 % |
25 %* |
|
Rémission sans corticoïdes depuis ≥ 90 joursa |
6 % |
13 %* |
|
|
|
|
|
Semaines 8 et 52 |
(N = 140) |
(N = 150) |
|
Réponse maintenue |
12 % |
24 %** |
|
Rémission maintenue |
4 % |
8 %* |
|
Cicatrisation de la muqueuse maintenue |
11 % |
19 %* |
Une rémission clinique est définie par un score Mayo ≤ 2 sans
aucun sous-score > 1 ;
La réponse clinique est une diminution par rapport à la valeur de base du score Mayo ≥ 3 points et ≥ 30 % associée à une diminution du sous-score de saignement rectal (SSR) ≥ 1 ou une valeur absolue du SSR de 0 ou 1 ;
* p < 0,05 pour l'adalimumab versus placebo, comparaisons appariées des pourcentages
** p < 0,001 pour l'adalimumab versus placebo, comparaisons appariées des pourcentages
a Parmi ceux initialement traités par corticoïdes
La réponse clinique est une diminution par rapport à la valeur de base du score Mayo ≥ 3 points et ≥ 30 % associée à une diminution du sous-score de saignement rectal (SSR) ≥ 1 ou une valeur absolue du SSR de 0 ou 1 ;
* p < 0,05 pour l'adalimumab versus placebo, comparaisons appariées des pourcentages
** p < 0,001 pour l'adalimumab versus placebo, comparaisons appariées des pourcentages
a Parmi ceux initialement traités par corticoïdes
Parmi les patients ayant une réponse clinique à la 8e semaine, 47 % étaient en réponse clinique, 29 % étaient en rémission, 41 % avaient une cicatrisation de la muqueuse et 20 % étaient en rémission sans corticoïdes depuis 90 jours ou plus à la semaine 52.
Environ 40 % des patients de l'étude II sur la RCH étaient en échec à un traitement par antagoniste du TNF antérieur par l'infliximab. L'efficacité de l'adalimumab chez ces patients était moindre versus celle chez les patients naïfs d'antagoniste du TNF. Parmi les patients en échec à un traitement par antagoniste du TNF antérieur, une rémission a été obtenue à la semaine 52 chez 3 % des patients sous placebo et 10 % des patients sous adalimumab.
Les patients des études I et II sur la RCH avaient la possibilité d'être inclus dans l'étude d'extension à long terme en ouvert (étude III sur la RCH). Après 3 ans de traitement par adalimumab, 75 % (301/402) continuaient à être en rémission clinique selon le score Mayo partiel.
Taux d'hospitalisation
Pendant les 52 semaines des études I et II dans la RCH, des taux plus faibles d'hospitalisation toutes causes confondues et d'hospitalisation liée à la RCH ont été observés dans le bras traité par adalimumab comparé au bras placebo. Le nombre d'hospitalisations toutes causes confondues dans le groupe traité par adalimumab était de 0,18 par patient-année versus 0,26 par patient-année dans le groupe placebo et le nombre correspondant d'hospitalisations liées à la RCH était de 0,12 par patientannée versus 0,22 par patient-année.
Qualité de vie
Dans l'étude II sur la RCH, le traitement par adalimumab entraînait des améliorations du score du questionnaire sur les maladies inflammatoires de l'intestin (IBDQ).
Uvéite
La tolérance et l'efficacité de l'adalimumab ont été évaluées chez des patients adultes atteints d'uvéite non infectieuse, intermédiaire, postérieure et de panuvéite, à l'exclusion des patients présentant une uvéite antérieure isolée, dans deux études randomisées, en double aveugle, contrôlées contre placebo (UV I et II). Les patients recevaient un placebo ou l'adalimumab à la dose initiale de 80 mg puis de 40 mg toutes les deux semaines en commençant une semaine après l'administration de la première dose. L'administration concomitante d'un immunosuppresseur non biologique à dose stable était autorisée.
L'étude UV I a évalué 217 patients présentant une uvéite active malgré un traitement par corticoïdes (prednisone par voie orale à la dose de 10 à 60 mg/jour). Au moment de l'inclusion dans l'étude, tous les patients ont reçu une dose standardisée de 60 mg/jour de prednisone pendant deux semaines, progressivement réduite selon un schéma imposé jusqu'à l'arrêt complet de la corticothérapie à la semaine 15.
L'étude UV II a évalué 226 patients présentant une uvéite inactive nécessitant une corticothérapie chronique (prednisone par voie orale à la dose de 10 à 35 mg/jour) au moment de l'inclusion pour contrôler leur maladie. La dose de corticoïdes était progressivement réduite selon un schéma imposé jusqu'à l'arrêt complet de la corticothérapie à la semaine 19.
Le critère d'évaluation principal de l'efficacité dans les deux études était le « délai de survenue de la rechute ». La rechute était définie par un résultat composite basé sur la présence de lésions vasculaires rétiniennes et/ou choriorétiniennes inflammatoires, le Tyndall cellulaire de la chambre antérieure, l'inflammation vitréenne et la meilleure acuité visuelle corrigée.
Les patients ayant terminé les études UV I et UV II étaient éligibles pour participer à une étude d'extension à long terme non contrôlée d'une durée initialement prévue de 78 semaines. Les patients ont été autorisés à continuer à prendre le médicament de l'étude au-delà de la semaine 78 jusqu'à ce qu'ils aient accès à l'adalimumab.
Réponse clinique
Les résultats des deux études ont mis en évidence une réduction statistiquement significative du risque de rechute chez les patients traités par adalimumab comparativement aux patients recevant le placebo (voir tableau 24). Les deux études ont montré un effet précoce et durable sur le taux de rechute sous adalimumab comparativement au placebo (voir figure 2).
Tableau 24.
Délai de survenue de la rechute dans les études UV
I et UV II
|
Analyse N Traitement |
Rechute N (%) |
Délai HRa médian de survenue de la rechute (mois) |
IC à 95 % pour le HRa |
Valeur de pb |
|
|
Délai de survenue de la rechut |
e à ou après l |
a semaine 6 dans l'étude UV I |
|
||
|
Analyse principale (ITT) Placebo 107 |
84 (78,5) |
3,0 -- -- |
-- |
||
|
Adalimumab 110 |
60 (54,5) |
5,6 0,50 0,36 ; 0,70 |
< 0,001 |
||
|
Délai de survenue de la rechut |
e à ou après l |
a semaine 2 dans l'étude UV II |
|
||
|
Analyse principale (ITT) Placebo 111 |
61 (55,0) |
8,3 |
-- |
-- |
-- |
|
Adalimumab 115 |
45 (39,1) |
NEc |
0,57 |
0,39 ; 0,84 |
0,004 |
Remarque : la rechute à ou après la semaine 6 (étude UV I) ou la semaine
2 (étude UV II) était comptabilisée comme un événement. Les sorties d'étude
pour d'autres raisons qu'une rechute étaient censurées au moment de la sortie
d'étude.
a HR pour l'adalimumab versus placebo par une analyse de régression à risque proportionnel ajusté sur le traitement.
b Valeur de p bilatérale selon le test de log-rank. c NE = non estimable. Moins de la moitié des patients à risque ont présenté un événement.
a HR pour l'adalimumab versus placebo par une analyse de régression à risque proportionnel ajusté sur le traitement.
b Valeur de p bilatérale selon le test de log-rank. c NE = non estimable. Moins de la moitié des patients à risque ont présenté un événement.
Figure 2. Courbes de Kaplan-Meier illustrant le délai de survenue de la rechute à ou après la semaine 6 (étude UV I) ou la semaine 2 (étude UV II)
Remarque : P# = Placebo (Nombre d'événements/Nombre de patients à risque) ; A# = Adalimumab (Nombre d'événements/Nombre de patients à risque)
Dans l'étude UV I, des différences statistiquement significatives en faveur de l'adalimumab versus placebo ont été observées pour chaque composante du critère de rechute. Dans l'étude UV II, des différences statistiquement significatives ont été observées seulement pour l'acuité visuelle, toutes les autres composantes étaient cependant numériquement en faveur de l'adalimumab.
Sur les 424 patients inclus dans l'extension à long-terme non contrôlée des études UV I et UV II, 60 patients ont été considérés inéligibles (par exemple, en raison de déviations ou en raison de complications secondaires à une rétinopathie diabétique, suite à une chirurgie de la cataracte ou une vitrectomie) et ont été exclus de l'analyse des critères d'efficacité primaires. Sur les 364 patients restants, 269 patients évaluables (74%) ont été traités pendant 78 semaines en ouvert par adalimumab. Sur la base des données observées, 216 (80,3 %) étaient en phase de quiescence (absence de lésions inflammatoires actives, Tyndall cellulaire ≤ 0,5+, inflammation vitréenne de grade ≤ 0,5+) avec corticothérapie concomitante à une dose ≤ 7,5 mg par jour, et 178 (66,2 %) étaient en phase de quiescence sans corticoïdes. La meilleure acuité visuelle corrigée était soit améliorée soit maintenue (détérioration < 5 lettres) pour 88,6 % des yeux évalués à la semaine 78. Les données au-delà de la semaine 78 concordaient généralement avec ces résultats, mais le nombre de sujets inscrits a diminué après cette période. En général, parmi les patients sortis de l'étude, 18 % ont arrêté l'étude en raison d'événements indésirables et 8 % en raison d'une réponse insuffisante au traitement par adalimumab.
Qualité de vie
Les résultats rapportés par les patients en termes de fonction visuelle ont fait l'objet d'une évaluation dans les deux études cliniques, à l'aide du questionnaire de qualité de vie NEI VFQ-25. La majorité des sous-scores étaient numériquement en faveur de l'adalimumab, avec des différences moyennes statistiquement significatives en termes de vision générale, douleur oculaire, vision de près, santé mentale, et de score total dans l'étude UV I, et en termes de vision générale et santé mentale dans l'étude UV II. Les liés à la vision n'étaient pas numériquement en faveur de l'adalimumab pour la vision des couleurs dans l'étude UV I et pour la vision des couleurs, la vision périphérique et la vision de près dans l'étude UV II.
Immunogénicité
Des anticorps anti-adalimumab peuvent se développer pendant le traitement par adalimumab. La formation d'anticorps anti-adalimumab est associée à une augmentation de la clairance et à une diminution de l'efficacité de l'adalimumab. Il n'y a pas de corrélation apparente entre la présence d'anticorps anti-adalimumab et la survenue d'effets indésirables.
Population pédiatrique
Arthrite juvénile idiopathique (AJI)
Arthrite juvénile idiopathique polyarticulaire (AJIp)
La tolérance et l'efficacité de l'adalimumab ont été évaluées dans deux études (AJIp I et II) chez des enfants ayant une arthrite juvénile idiopathique polyarticulaire active ou une AJI d'évolution polyarticulaire, qui présentaient différentes formes de début de la maladie (le plus souvent polyarthrite avec facteur rhumatoïde négatif ou positif et oligoarthrite étendue).
AJIp I
La tolérance et l'efficacité de l'adalimumab ont été évaluées dans une étude multicentrique randomisée en double aveugle en groupes parallèles menée chez 171 enfants (de 4 à 17 ans) présentant une AJI polyarticulaire. Dans la phase de pré-inclusion en ouvert (PI-O), les patients ont été stratifiés en deux groupes : patients traités par MTX (méthotrexate) ou non traités par MTX. Les patients de la strate « sans MTX » étaient naïfs de traitement ou le MTX avait été arrêté deux semaines au moins avant l'administration du médicament à l'étude. Les patients sont restés sous doses stables d'antiinflammatoires non stéroïdiens (AINS) et/ou de prednisone (≤ 0,2 mg/kg/jour ou 10 mg/jour au maximum). Dans la phase de pré-inclusion en ouvert, tous les patients ont reçu 24 mg/m2 d'adalimumab, jusqu'à un maximum de 40 mg, toutes les deux semaines pendant 16 semaines. Le tableau 25 présente la distribution des patients par âge et doses minimales, médianes et maximales reçues pendant la phase de pré-inclusion en ouvert.
Tableau 25.
Distribution des patients par âge et doses
d'adalimumab reçues pendant la phase de préinclusion en ouvert
|
Groupe d'âge |
Nombre de patients au début de l'étude n (%) |
Dose minimale, médiane et maximale |
|
4 à 7 ans |
31 (18,1) |
10, 20 et 25 mg |
|
8 à 12 ans |
71 (41,5) |
20, 25 et 40 mg |
|
13 à 17 ans |
69 (40,4) |
25, 40 et 40 mg |
Les patients présentant une réponse ACR 30 pédiatrique en semaine 16 étaient éligibles pour être randomisés dans la phase en double aveugle (DA) et ils ont reçu l'adalimumab à raison de 24 mg/m2 jusqu'à un maximum de 40 mg ou le placebo toutes les deux semaines pendant 32 semaines de plus ou jusqu'à une poussée de la maladie. Une poussée était définie comme une aggravation d'au moins 30 % d'au moins 3 des 6 critères du score ACR pédiatrique, la présence d'au moins 2 articulations actives et une amélioration supérieure à 30 % d'un critère seulement sur les six. Après 32 semaines ou au moment d'une poussée de la maladie, les patients étaient éligibles pour entrer dans la phase d'extension en ouvert.
Tableau 26.
Réponses ACR 30 Pédiatrique dans l'étude de l'AJI
|
Strate |
MTX |
Sans MTX |
||
|
Phase |
|
|
||
|
Pré-inclusion en ouvert de 16 semaines |
|
|
||
|
Réponse ACR 30 Péd. (n/N) |
94,1 % (80/85) |
74,4 % (64/86) |
||
|
|
Résultats d'efficacité |
|
||
|
Phase en double aveugle de 32 semaines |
Adalimumab/MTX (N = 38) |
Placebo/MTX (N = 37) |
Adalimumab (N = 30) |
Placebo (N = 28) |
|
Strate |
MTX |
Sans MTX |
||
|
Phase |
|
|
||
|
Poussées de la maladie à la fin des 32 semainesa (n/N) |
36,8 % (14/38) |
64,9 % (24/37)b |
43,3 % (13/30) |
71,4 % (20/28)c |
|
Délai médian jusqu'à une poussée de la maladie |
> 32 semaines |
20 semaines |
> 32 semaines |
14 semaines |
a
Réponses
ACR Péd. 30/50/70 en semaine 48 significativement plus élevées que celles des
patients sous placebo
b p = 0,015
c p = 0,031
b p = 0,015
c p = 0,031
Chez les sujets qui avaient répondu en semaine 16 (n = 144), les réponses ACR pédiatriques 30/50/70/90 ont été maintenues pendant des durées allant jusqu'à six ans dans la phase d'extension en ouvert chez les patients qui avaient reçu l'adalimumab pendant toute l'étude. Dix-neuf patients dont 11 du groupe d'âge de 4 à 12 ans et 8 du groupe d'âge de 13 à 17 ans ont été traités pendant 6 ans ou plus.
Les réponses globales ont été généralement supérieures et le nombre de patients ayant développé des anticorps a été plus faible avec l'association adalimumab plus MTX qu'avec l'adalimumab en monothérapie. En tenant compte de ces résultats, l'adalimumab est recommandé en association avec le MTX et en monothérapie chez les patients pour lesquels le traitement par MTX est inadapté (voir rubrique Posologie et mode d'administration).
AJIp II
La tolérance et l'efficacité de l'adalimumab ont été évaluées dans une étude en ouvert, multicentrique chez 32 enfants (âgés de 2 à 4 ans ou âgés de 4 ans et plus, de poids < 15 kg) présentant une AJI polyarticulaire modérément à sévèrement active. Les patients ont reçu l'adalimumab à la dose de 24 mg/m2 de surface corporelle jusqu'à une dose maximale de 20 mg en une seule injection souscutanée toutes les 2 semaines pendant au moins 24 semaines. Durant l'étude, la plupart des patients avaient un traitement concomitant par MTX, une plus faible proportion avait des corticoïdes ou des AINS.
À la semaine 12 et à la semaine 24, la réponse ACR 30 pédiatrique était de 93,5 % et de 90,0 %, respectivement, en utilisant les données observées. La proportion de patients avec ACR 50/70/90 pédiatrique à la semaine 12 et à la semaine 24 était respectivement de 90,3 %/61,3 %/38,7 % et 83,3 %/73,3 %/36,7 %. Parmi ceux ayant répondu (ACR 30 pédiatrique) à la semaine 24 (n = 27 sur les 30 patients), la réponse ACR 30 Pédiatrique était maintenue jusqu'à 60 semaines dans la phase d'extension en ouvert chez les patients qui ont reçu l'adalimumab durant toute cette période. Globalement, 20 patients ont été traités pendant 60 semaines ou plus.
Arthrite liée à l'enthésite
La tolérance et l'efficacité de l'adalimumab ont été évaluées dans une étude multicentrique, randomisée en double aveugle chez 46 patients pédiatriques (âgés de 6 à 17 ans) présentant une arthrite liée à l'enthésite modérée. Les patients ont été randomisés pour recevoir, toutes les deux semaines pendant 12 semaines, soit une dose d'adalimumab de 24 mg/m2 de surface corporelle jusqu'à une dose maximale de 40 mg, soit un placebo. La phase en double aveugle a été suivie d'une phase en ouvert durant laquelle les patients recevaient une dose d'adalimumab de 24 mg/m2 de surface corporelle jusqu'à une dose maximale de 40 mg toutes les deux semaines par voie sous-cutanée pendant 192 semaines supplémentaires. Le critère d'évaluation principal était la variation en pourcentage du nombre d'articulations actives touchées par l'arthrite (gonflement non lié à une malformation ou articulations avec perte de mouvement et douleur et/ou sensibilité) entre l'inclusion et la semaine 12. Une réduction moyenne de -62,6 % (variation médiane : -88,9 %) a été observée chez les patients traités par l'adalimumab par rapport à -11,6 % (variation médiane : -50,0 %) chez les patients recevant le placebo. L'amélioration relative au nombre d'articulations actives touchées par l'arthrite a été maintenue au cours de la phase en ouvert jusqu'à la semaine 156 pour les 26 patients sur 31 (84 %) du groupe adalimumab qui sont restés dans l'étude. Une amélioration clinique mais non statistiquement significative a été observée chez la majorité des patients pour les critères secondaires tels que le nombre de sites d'enthésite, le nombre d'articulations douloureuses, le nombre d'articulations gonflées, et la réponse selon les critères ACR 50 et 70 pédiatriques.
Psoriasis en plaques pédiatrique
L'efficacité de l'adalimumab a été évaluée dans une étude contrôlée, randomisée en double aveugle chez 114 patients pédiatriques âgés de 4 ans et plus présentant un psoriasis en plaques chronique sévère (défini par un score PGA [Physician's Global Assessment] ≥ 4 ou une atteinte de la surface corporelle > 20 % ou > 10 % avec des lésions très épaisses ou un score du PASI [Psoriasis Area and Severity Index] ≥ 20 ou ≥ 10 avec atteinte cliniquement significative du visage, des organes génitaux ou des mains et/ou pieds) qui n'était pas suffisamment contrôlé par un traitement topique et l'héliothérapie ou la photothérapie.
Les patients ont reçu l'adalimumab à la dose de 0,8 mg/kg toutes les deux semaines (jusqu'à 40 mg) ou 0,4 mg/kg toutes les deux semaines (jusqu'à 20 mg) ou le méthotrexate à la dose de 0,1 à 0,4 mg/kg une fois par semaine (jusqu'à 25 mg). À la semaine 16, il y a eu plus de répondeurs (par ex. PASI 75) chez les patients randomisés dans le groupe adalimumab 0,8 mg/kg toutes les deux semaines par rapport aux patients randomisés dans le groupe adalimumab 0,4 mg/kg toutes les deux semaines ou le MTX.
Tableau 27.
Psoriasis en plaques pédiatrique — Résultats
d'efficacité à 16 semaines
|
|
MTXa N = 37 |
Adalimumab 0,8 mg/kg toutes les deux semaines N = 38 |
|
PASI 75b |
12 (32,4 %) |
22 (57,9 %) |
|
PGA : clair/minimalc |
15 (40,5 %) |
23 (60,5 %) |
a
MTX =
méthotrexate
b p = 0,027, adalimumab 0,8 mg/kg versus MTX
c p = 0,083, adalimumab 0,8 mg/kg versus MTX
b p = 0,027, adalimumab 0,8 mg/kg versus MTX
c p = 0,083, adalimumab 0,8 mg/kg versus MTX
Chez les patients ayant obtenu un score PASI 75 et un score PGA « clair ou minimal », le traitement a été arrêté pendant une durée allant jusqu'à 36 semaines et ils ont été suivis pour détecter une perte de contrôle de la maladie (c'est-à-dire une aggravation d'au moins 2 grades du score PGA). Les patients ont ensuite été retraités par l'adalimumab 0,8 mg/kg toutes les deux semaines pendant 16 semaines supplémentaires et les taux de réponse observés pendant le retraitement ont été comparables à ceux rapportés pendant la phase en double aveugle antérieure : réponse PASI 75 chez 78,9 % des patients (15 sur 19) et score PGA « clair ou minimal » chez 52,6 % (10 sur 19).
Dans la phase en ouvert de l'étude, les réponses PASI 75 et PGA « clair ou minimal » ont été maintenues pendant une durée allant jusqu'à 52 semaines supplémentaires sans nouveaux signaux de sécurité.
Hidrosadénite suppurée de l'adolescent
Il n'existe pas d'essai clinique conduit avec l'adalimumab chez des adolescents atteints d'HS. L'efficacité de l'adalimumab pour le traitement des adolescents atteints d'HS est prédite sur la base de l'efficacité et de la relation exposition-réponse démontrées chez des patients adultes atteints d'HS ainsi que de la probabilité que l'évolution de la maladie, sa physiopathologie et les effets du médicament soient sensiblement similaires à ceux observés chez les adultes aux mêmes niveaux d'exposition. La tolérance de la dose recommandée d'adalimumab chez les adolescents atteints d'HS est basée sur le profil de tolérance de l'adalimumab dans ses indications croisées chez les adultes et chez les patients pédiatriques à des doses similaires ou plus fréquentes (voir rubrique Propriétés pharmacocinétiques).
Maladie de Crohn pédiatrique
Une étude clinique multicentrique, randomisée, en double aveugle a évalué l'efficacité et la tolérance de l'adalimumab dans le traitement d'induction et le traitement d'entretien à des doses déterminées en fonction du poids (< 40 kg ou ≥ 40 kg) chez 192 patients pédiatriques âgés de 6 à 17 ans (inclus), présentant une maladie de Crohn (MC) modérée à sévère, définie par un indice d'activité de la maladie de Crohn chez l'enfant (Paediatric Crohn's Disease Activity Index [PCDAI]) > 30. Les patients devaient ne pas avoir répondu à un traitement conventionnel de la MC (comprenant un corticoïde et/ou un immunomodulateur). Les patients pouvaient également ne plus répondre ou être intolérants à l'infliximab.
Tous les patients ont reçu un traitement d'induction en ouvert à une dose déterminée en fonction de leur poids initial : 160 mg à la semaine 0 et 80 mg à la semaine 2 pour les patients de poids ≥ 40 kg et respectivement 80 mg et 40 mg pour les patients de poids < 40 kg.
À la semaine 4, les patients ont été randomisés selon un rapport 1/1, en fonction de leur poids à cette date, pour recevoir le schéma posologique d'entretien soit à dose faible soit à dose standard, comme le montre le tableau 28.
Tableau 28.
Schéma posologique d'entretien
|
Poids du patient |
Dose faible |
Dose standard |
|
< 40 kg |
10 mg toutes les deux semaines |
20 mg toutes les deux semaines |
|
≥ 40 kg |
20 mg toutes les deux semaines |
40 mg toutes les deux semaines |
Résultats d'efficacité
Le critère d'évaluation principal de l'étude était la rémission clinique à la semaine 26, définie par un score PCDAI ≤ 10.
Les taux de rémission clinique et de réponse clinique (définie par une réduction du score PCDAI d'au moins 15 points par rapport à la valeur initiale) sont présentés dans le tableau 29. Les taux d'arrêt des corticoïdes ou des immunomodulateurs sont présentés dans le tableau 30.
Tableau 29.
Étude sur la MC pédiatrique — Rémission et réponse
cliniques (PCDAI)
|
|
Dose standard 40/20 mg toutes les deux semaines N = 93 |
Dose faible 20/10 mg toutes les deux semaines N = 95 |
Valeur de p* |
|
Semaine 26 |
|
|
|
|
Rémission clinique |
38,7 % |
28,4 % |
0,075 |
|
Réponse clinique |
59,1 % |
48,4 % |
0,073 |
|
Semaine 52 |
|
|
|
|
Rémission clinique |
33,3 % |
23,2 % |
0,100 |
|
Réponse clinique |
41,9 % |
28,4 % |
0,038 |
* Valeur de p pour la comparaison dose standard versus
dose faible.
Tableau 30.
Étude sur la MC pédiatrique — Arrêt des
corticoïdes ou des immunomodulateurs et fermeture des fistules
|
|
Dose standard 40/20 mg toutes les deux semaines |
Dose faible 20/10 mg toutes les deux semaines |
Valeur de p1 |
|
Arrêt des corticoïdes |
N = 33 |
N = 38 |
|
|
Semaine 26 |
84,8 % |
65,8 % |
0,066 |
|
Semaine 52 |
69,7 % |
60,5 % |
0,420 |
|
Arrêt des immunomodulateurs2 |
N = 60 |
N = 57 |
|
|
Semaine 52 |
30,0 % |
29,8 % |
0,983 |
|
Fermeture des fistules3 |
N = 15 |
N = 21 |
|
|
Semaine 26 |
46,7 % |
38,1 % |
0,608 |
|
Semaine 52 |
40,0 % |
23,8 % |
0,303 |
1
Valeur de p
pour la comparaison dose standard versus dose faible.
2 Le traitement immunosuppresseur ne pouvait être arrêté qu'à partir de la semaine 26, à la libre appréciation de l'investigateur, si le patient répondait au critère de réponse clinique
3 Définie comme la fermeture de toutes les fistules, à au moins 2 visites consécutives après la visite initiale
2 Le traitement immunosuppresseur ne pouvait être arrêté qu'à partir de la semaine 26, à la libre appréciation de l'investigateur, si le patient répondait au critère de réponse clinique
3 Définie comme la fermeture de toutes les fistules, à au moins 2 visites consécutives après la visite initiale
Des augmentations statistiquement significatives (amélioration) de l'indice de masse corporelle et de la vitesse de croissance staturale ont été observées dans les deux groupes de traitement entre la visite initiale et les semaines 26 et 52.
Des améliorations statistiquement et cliniquement significatives par rapport à la visite initiale ont également été observées dans les deux groupes de traitement pour les paramètres de qualité de vie (y compris IMPACT III).
Cent patients (n = 100) issus de l'étude sur la MC pédiatrique ont été inclus dans une étude d'extension à long terme en ouvert. Après 5 ans de traitement par adalimumab, 74,0 % (37/50) des 50 patients restant dans l'étude continuaient à être en rémission clinique et 92,0 % (46/50) des patients continuaient à être en réponse clinique selon le score PCDAI.
Rectocolite hémorragique pédiatrique
La tolérance et l'efficacité de l'adalimumab ont été évaluées dans une étude multicentrique, randomisée, en double aveugle, menée chez 93 patients pédiatriques âgés de 5 à 17 ans et atteints de rectocolite hémorragique modérée à sévère (score Mayo de 6 à 12 avec un sous-score endoscopique de 2 à 3 points, confirmé par une endoscopie évaluée par une relecture centralisée) qui présentaient une réponse inadéquate ou une intolérance au traitement conventionnel. Environ 16 % des patients de l'étude étaient en échec d'un précédent traitement par anti-TNF. Les patients recevant des corticoïdes au moment de l'inclusion ont été autorisés à diminuer progressivement leur traitement par corticoïdes après la semaine 4.
Au cours de la période d'induction de l'étude, 77 patients ont été randomisés (3/2) pour recevoir un traitement en double aveugle par adalimumab à une dose d'induction de 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0 et à la semaine 1, et de 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2 ; ou une dose d'induction de 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0, un placebo à la semaine 1 et une dose de 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2. Les deux groupes ont reçu une dose de 0,6 mg/kg (dose maximale de 40 mg) à la semaine 4 et à la semaine 6. Suite à un amendement de l'étude, les 16 patients restants ayant participé à la période d'induction ont reçu un traitement en ouvert par adalimumab à la dose d'induction de 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0 et à la semaine 1, et de 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2.
À la semaine 8, 62 patients ayant présenté une réponse clinique selon le Score Mayo partiel (SMP ; définie comme une diminution du SMP ≥ 2 points et ≥ 30 % par rapport à la valeur initiale) ont été randomisés pour recevoir un traitement d'entretien en double aveugle par adalimumab à une dose de 0,6 mg/kg (dose maximale de 40 mg) chaque semaine, ou une dose d'entretien de 0,6 mg/kg (dose maximale de 40 mg) toutes les deux semaines. Avant un amendement de l'étude, 12 patients supplémentaires ayant présenté une réponse clinique d'après le SMP ont été randomisés pour recevoir un placebo, mais ces derniers n'ont pas été inclus dans l'analyse de confirmation de l'efficacité.
Une poussée de la maladie était définie comme une augmentation du SMP d'au moins 3 points (pour les patients présentant un SMP de 0 à 2 à la semaine 8), d'au moins 2 points (pour les patients présentant un SMP de 3 à 4 à la semaine 8), ou d'au moins 1 point (pour les patients présentant un SMP de 5 à 6 à la semaine 8).
Les patients dont l'état répondait aux critères de poussée de la maladie à la semaine 12 ou après ont été randomisés pour recevoir une dose de réinduction de 2,4 mg/kg (dose maximale de 160 mg) ou une dose de 0,6 mg/kg (dose maximale de 40 mg) et ont conservé leur dose d'entretien respective par la suite.
Résultats d'efficacité
Les co-critères principaux d'évaluation de l'étude étaient la rémission clinique selon le SMP (définie par un SMP ≤ 2 sans aucun sous-score individuel > 1) à la semaine 8, et la rémission clinique selon le score SMT (score Mayo total) (définie par un score Mayo ≤ 2 sans aucun sous-score individuel > 1) à la semaine 52 chez les patients ayant obtenu une réponse clinique d'après le SMP à la semaine 8.
À la semaine 8, les taux de rémission clinique selon le SMP pour les patients de chaque groupe ayant reçu le traitement d'induction par adalimumab en double aveugle sont présentés dans le tableau 31.
Tableau 31.
Rémission clinique selon le SMP à 8 semaines
|
|
Adalimumaba Dose maximale de 160 mg à la semaine 0/placebo à la semaine 1 N = 30 |
Adalimumabb,c Dose maximale de 160 mg à la semaine 0 et à la semaine 1 N = 47 |
|
Rémission clinique |
13/30 (43,3 %) |
28/47 (59,6 %) |
a Adalimumab 2,4 mg/kg (dose maximale de 160 mg) à la semaine
0, placebo à la semaine 1, et 1,2 mg/kg (dose maximale de 80 mg) à la semaine
2
b Adalimumab 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0 et à la semaine 1, et 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2
c En excluant la dose d'induction en ouvert d'adalimumab de 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0 et à la semaine 1, et de 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2
Remarque 1 : les deux groupes du traitement d'induction ont reçu une dose de 0,6 mg/kg (dose maximale de 40 mg) à la semaine 4 et à la semaine 6
Remarque 2 : pour les patients dont les valeurs étaient manquantes à la semaine 8, le critère d'évaluation est considéré comme n'étant pas atteint
b Adalimumab 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0 et à la semaine 1, et 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2
c En excluant la dose d'induction en ouvert d'adalimumab de 2,4 mg/kg (dose maximale de 160 mg) à la semaine 0 et à la semaine 1, et de 1,2 mg/kg (dose maximale de 80 mg) à la semaine 2
Remarque 1 : les deux groupes du traitement d'induction ont reçu une dose de 0,6 mg/kg (dose maximale de 40 mg) à la semaine 4 et à la semaine 6
Remarque 2 : pour les patients dont les valeurs étaient manquantes à la semaine 8, le critère d'évaluation est considéré comme n'étant pas atteint
À la semaine 52, la rémission clinique selon le SMT chez les patients ayant présenté une réponse clinique à la semaine 8, la réponse clinique selon le SMT (définie comme une diminution du score Mayo ≥ 3 points et ≥ 30 % par rapport à l'inclusion) chez les patients ayant présenté une réponse à la semaine 8, la cicatrisation de la muqueuse (définie comme un sous-score endoscopique Mayo ≤ 1) chez les patients ayant présenté une réponse à la semaine 8, la rémission clinique selon le SMT chez les patients en rémission à la semaine 8, et la proportion de patients en rémission sans corticoïdes selon le SMT chez les patients ayant présenté une réponse à la semaine 8 ont été évaluées pour les patients ayant reçu l'adalimumab en double aveugle à la dose d'entretien maximale de 40 mg 1 semaine sur 2 (0,6 mg/kg) et à la dose d'entretien maximale de 40 mg chaque semaine (0,6 mg/kg) (tableau 32).
Tableau 32.
Résultats d'efficacité à 52 semaines
|
|
Adalimumaba Dose maximale de 40 mg 1 semaine sur 2 N = 31 |
Adalimumabb Dose maximale de 40 mg chaque semaine N = 31 |
|
Rémission clinique chez les répondeurs à la semaine 8 selon le SMP |
9/31 (29,0 %) |
14/31 (45,2 %) |
|
Réponse clinique chez les répondeurs à la semaine 8 selon le SMP |
19/31 (61,3 %) |
21/31 (67,7 %) |
|
Cicatrisation de la muqueuse chez les répondeurs à la semaine 8 selon le SMP |
12/31 (38,7 %) |
16/31 (51,6 %) |
|
Rémission clinique chez les patients en rémission à la semaine 8 selon le SMP |
9/21 (42,9 %) |
10/22 (45,5 %) |
|
Rémission sans corticoïdes chez les répondeurs à la semaine 8 selon le SMPc |
4/13 (30,8 %) |
5/16 (31,3 %) |
a Adalimumab 0,6 mg/kg (dose maximale de 40 mg) toutes
les deux semaines
b Adalimumab 0,6 mg/kg (dose maximale de 40 mg) chaque semaine
c Pour les patients recevant un traitement concomitant par corticoïdes à l'inclusion
Remarque : les patients dont les valeurs étaient manquantes à la semaine 52 ou qui ont été randomisés pour recevoir un traitement de réinduction ou d'entretien ont été considérés comme non répondeurs d'après les critères d'évaluation de la semaine 52
b Adalimumab 0,6 mg/kg (dose maximale de 40 mg) chaque semaine
c Pour les patients recevant un traitement concomitant par corticoïdes à l'inclusion
Remarque : les patients dont les valeurs étaient manquantes à la semaine 52 ou qui ont été randomisés pour recevoir un traitement de réinduction ou d'entretien ont été considérés comme non répondeurs d'après les critères d'évaluation de la semaine 52
Les autres critères d'évaluation exploratoires de l'efficacité comprenaient la réponse clinique selon l'indice d'activité de la rectocolite hémorragique pédiatrique (Paediatric Ulcerative Colitis Activity Index, PUCAI) (définie comme une diminution de l'indice PUCAI ≥ 20 points par rapport à l'inclusion) et la rémission clinique selon l'indice PUCAI (définie comme un indice PUCAI < 10) à la semaine 8 et à la semaine 52 (tableau 33).
Tableau 33.
Résultats des critères d'évaluation exploratoires selon l'indice PUCAI
|
|
Semaine 8 |
|
|
Adalimumaba Dose maximale de 160 mg à la semaine 0/placebo à la semaine 1 N = 30 |
Adalimumabb,c Dose maximale de 160 mg à la semaine 0 et à la semaine 1 N = 47 |
|
|
Rémission clinique selon l'indice PUCAI |
10/30 (33,3 %) |
22/47 (46,8 %) |
|
Réponse clinique selon l'indice PUCAI |
15/30 (50,0 %) |
32/47 (68,1 %) |
|
|
Semaine 52 |
|
|
Adalimumabd Dose maximale de 40 mg 1 semaine sur 2 N = 31 |
Adalimumabe Dose maximale de 40 mg chaque semaine N = 31 |
|
|
Rémission clinique chez les répondeurs à la semaine 8 selon l'indice PUCAI |
14/31 (45,2 %) |
18/31 (58,1 %) |
|
Réponse clinique chez les répondeurs à la semaine 8 selon l'indice PUCAI |
18/31 (58,1 %) |
16/31 (51,6 %) |
a Adalimumab 2,4 mg/kg (dose maximale de 160 mg) à la semaine
0, placebo à la semaine 1, et 1,2 mg/kg (dose maximale de 80 mg) à la semaine
2
b Adalimumab 2,4 mg/kg (dose maximale de 160 mg)
à la semaine 0 et à la semaine 1, et 1,2 mg/kg (dose maximale de 80 mg) à la
semaine 2
c
En excluant
la dose d'induction en ouvert d'adalimumab de 2,4 mg/kg (dose maximale de 160
mg) à la semaine 0 et à la semaine 1, et de 1,2 mg/kg (dose maximale de 80 mg)
à la semaine 2
d
Adalimumab
0,6 mg/kg (dose maximale de 40 mg) toutes les deux semaines
e Adalimumab
0,6 mg/kg (dose maximale de 40 mg) chaque semaine
Remarque 1 : les deux groupes du traitement d'induction ont
reçu une dose de 0,6 mg/kg (dose maximale de 40 mg) à la semaine 4 et à la
semaine 6
Remarque 2 : pour les patients dont
les valeurs étaient manquantes à la semaine 8, les critères d'évaluation sont
considérés comme n'étant pas atteints
Remarque 3 : les patients dont les valeurs étaient manquantes
à la semaine 52 ou qui ont été randomisés pour recevoir un traitement de
réinduction ou d'entretien ont été considérés comme non répondeurs d'après les
critères d'évaluation de la semaine 52
Parmi les patients traités par adalimumab qui ont reçu un traitement de réinduction pendant la période d'entretien, 2/6 (33 %) ont présenté une réponse clinique selon le SMT à la semaine 52.
Qualité de vie
Par rapport aux données d'inclusion, des améliorations cliniquement significatives ont été observées au niveau des paramètres IMPACT III et des scores du questionnaire à remplir par le soignant sur la productivité au travail et la limitation des activités (Work Productivity and Activity Impairment, WPAI) dans les groupes traités par adalimumab.
Par rapport aux données d'inclusion, des augmentations cliniquement significatives (amélioration) de la vitesse de croissance staturale ont été observées dans les groupes traités par adalimumab, et des augmentations cliniquement significatives (amélioration) de l'indice de masse corporelle ont été observées chez les sujets recevant la dose d'entretien élevée de 40 mg (0,6 mg/kg) maximum chaque semaine.
Uvéite pédiatrique
La tolérance et l'efficacité de l'adalimumab ont été évaluées dans une étude randomisée, contrôlée, en double aveugle, conduite chez 90 patients pédiatriques âgés de 2 à < 18 ans atteints d'uvéite active antérieure non infectieuse associée à une AJI qui étaient réfractaires à un traitement d'au moins 12 semaines par le méthotrexate. Les patients ont reçu soit un placebo soit 20 mg d'adalimumab (s'ils pesaient < 30 kg) ou 40 mg d'adalimumab (s'ils pesaient ≥ 30 kg) toutes les deux semaines en association avec leur dose initiale de méthotrexate.
Le critère d'évaluation principal était le « délai de survenue de la rechute ». Les critères déterminant la rechute étaient une aggravation ou l'absence prolongée d'amélioration de l'inflammation oculaire, une amélioration partielle avec le développement de comorbidités oculaires prolongées ou l'aggravation des comorbidités oculaires, l'utilisation non autorisée de médicaments concomitants et la suspension du traitement sur une durée de temps prolongée.
Réponse clinique
L'adalimumab a retardé de manière significative le délai de survenue de la rechute versus placebo (voir figure 3, p < 0,0001, test de log rank). Le délai médian de survenue de la rechute était de 24,1 semaines pour les patients recevant le placebo, tandis que le délai médian de survenue de la rechute n'a pas pu être estimé pour les patients traités par l'adalimumab car moins de la moitié de ces patients a présenté une rechute. L'adalimumab a diminué de manière significative le risque de rechute de 75 % par rapport au placebo, comme le montre le hazard ratio (HR = 0,25 [IC à 95 % : 0,12 ; 0,49]).
Figure 3. Courbes de Kaplan-Meier illustrant le délai de survenue de la rechute dans l'étude sur l'uvéite pédiatrique
Remarque : P = Placebo (Nombre de patients à risque) ; H = Adalimumab (Nombre de patients à risque).
Absorption et distribution
Après administration sous-cutanée d'une dose unique de 40 mg, l'absorption et la distribution de l'adalimumab ont été lentes, le pic de concentration sérique étant atteint 5 jours environ après l'administration. La biodisponibilité absolue moyenne de l'adalimumab, estimée à partir de trois études, a été de 64 % après une dose sous-cutanée unique de 40 mg. Après administration de doses intraveineuses uniques variant de 0,25 à 10 mg/kg, les concentrations ont été proportionnelles à la dose. Après administration de doses de 0,5 mg/kg (~40 mg), les clairances étaient de 11 à 15 ml/heure, le volume de distribution (Vss) était compris entre 5 et 6 litres, la demi-vie terminale moyenne a été de deux semaines environ. La concentration d'adalimumab dans le liquide synovial de plusieurs patients atteints de polyarthrite rhumatoïde était comprise entre 31 et 96 % des concentrations sériques.
Après administration sous-cutanée de 40 mg d'adalimumab toutes les deux semaines chez des patients adultes atteints de polyarthrite rhumatoïde (PR), les concentrations résiduelles moyennes à l'état d'équilibre étaient de l'ordre d'environ 5 μg/ml (sans méthotrexate) et de 8 à 9 μg/ml (avec méthotrexate). Les concentrations sériques résiduelles d'adalimumab à l'état d'équilibre ont augmenté de façon à peu près dose-dépendante après l'administration par voie sous-cutanée de 20, 40 et 80 mg toutes les deux semaines et toutes les semaines.
Après administration sous-cutanée de 24 mg/m2 (maximum de 40 mg) toutes les deux semaines chez des patients atteints d'arthrite juvénile idiopathique (AJI) polyarticulaire âgés de 4 à 17 ans, la concentration sérique résiduelle moyenne de l'adalimumab à l'état d'équilibre (valeurs mesurées des semaines 20 à 48) était de 5,6 ± 5,6 µg/ml (CV 102 %) lorsque l'adalimumab était administré sans traitement concomitant par le méthotrexate et de 10,9 ± 5,2 µg/ml (CV 47,7 %) en cas d'administration concomitante avec le méthotrexate.
Chez les patients atteints d'AJI polyarticulaire âgés de 2 à < 4 ans ou âgés de 4 ans et plus d'un poids < 15 kg ayant reçu l'adalimumab à la dose de 24 mg/m2, la concentration sérique résiduelle moyenne de l'adalimumab à l'état d'équilibre était de 6,0 ± 6,1 µg/ml (CV 101 %) lorsque l'adalimumab était administré sans traitement concomitant par méthotrexate et de 7,9 ± 5,6 µg/ml (CV 71,2 %) en cas d'administration concomitante avec le méthotrexate.
Après administration sous-cutanée d'une dose de 24 mg/m2 (dose maximale de 40 mg) toutes les deux semaines chez des patients atteints d'arthrite liée à l'enthésite âgés de 6 à 17 ans, la concentration sérique résiduelle moyenne de l'adalimumab à l'état d'équilibre (valeurs mesurées à la semaine 24) était de 8,8 ± 6,6 µg/ml lorsque l'adalimumab était administré sans traitement concomitant par méthotrexate et de 11,8 ± 4,3 µg/ml en cas d'administration concomitante avec le méthotrexate.
Après administration sous-cutanée de 40 mg d'adalimumab toutes les deux semaines chez des patients adultes atteints de spondyloarthrite axiale sans signes radiographiques, la concentration résiduelle moyenne à l'état d'équilibre de l'adalimumab (moyenne ± ET) à la semaine 68 était de 8,0 ± 4,6 μg/ml.
Chez les patients adultes atteints de psoriasis, la concentration résiduelle moyenne à l'état d'équilibre était de 5 μg/ml pendant le traitement par 40 mg d'adalimumab toutes les deux semaines en monothérapie.
Après administration sous-cutanée de 0,8 mg/kg (dose maximale de 40 mg) toutes les deux semaines chez des patients pédiatriques atteints de psoriasis en plaques chronique, la concentration résiduelle moyenne de l'adalimumab à l'état d'équilibre (moyenne ± ET) était d'environ 7,4 ± 5,8 µg/ml (CV 79 %).
Chez les patients adultes atteints d'hidrosadénite suppurée, une dose de 160 mg d'adalimumab à la semaine 0 suivie d'une dose de 80 mg à la semaine 2, ont permis d'obtenir des concentrations sériques résiduelles d'adalimumab d'environ 7 à 8 μg/ml à la semaine 2 et à la semaine 4. Au cours du traitement par adalimumab 40 mg par semaine, les concentrations sériques résiduelles moyennes à l'état d'équilibre, de la semaine 12 jusqu'à la semaine 36, étaient d'environ 8 à 10 μg/ml.
L'exposition à l'adalimumab chez les adolescents atteints d'HS a été prédite en utilisant une modélisation pharmacocinétique de population et une simulation basées sur la pharmacocinétique observée dans des indications croisées chez d'autres patients pédiatriques (psoriasis pédiatrique, arthrite juvénile idiopathique, maladie de Crohn pédiatrique et arthrite liée à l'enthésite). Le schéma posologique recommandé chez les adolescents atteints d'HS est 40 mg toutes les deux semaines. Comme l'exposition à l'adalimumab peut être modifiée par la masse corporelle, les adolescents avec un poids corporel plus élevé et une réponse insuffisante pourraient bénéficier de la dose recommandée chez l'adulte de 40 mg par semaine.
Chez les patients atteints de la maladie de Crohn, la dose de charge de 80 mg d'adalimumab à la semaine 0 suivie de 40 mg d'adalimumab à la semaine 2 permet d'obtenir des concentrations sériques résiduelles d'adalimumab d'environ 5,5 µg/ml pendant la période d'induction. Une dose de charge de 160 mg d'adalimumab à la semaine 0 suivie de 80 mg d'adalimumab à la semaine 2 permet d'obtenir des concentrations sériques résiduelles d'adalimumab d'environ 12 µg/ml pendant la période d'induction. Des concentrations résiduelles moyennes à l'état d'équilibre d'environ 7 µg/ml ont été obtenues chez des patients atteints de la maladie de Crohn ayant reçu une dose d'entretien de 40 mg d'adalimumab toutes les deux semaines.
Chez les enfants et les adolescents atteints de MC modérée à sévère, la dose d'induction de l'adalimumab en ouvert était respectivement de 160/80 mg ou 80/40 mg aux semaines 0 et 2, en fonction d'une valeur seuil de poids de 40 kg. À la semaine 4, les patients ont été randomisés selon un rapport de 1/1 pour recevoir un traitement d'entretien soit à la dose standard (40/20 mg toutes les deux semaines) soit à la dose faible (20/10 mg toutes les deux semaines) en fonction de leur poids. Les concentrations sériques résiduelles moyennes (± ET) de l'adalimumab obtenues à la semaine 4 étaient de 15,7 ± 6,6 μg/ml chez les patients de poids ≥ 40 kg (160/80 mg) et de 10,6 ± 6,1 μg/ml chez les patients de poids < 40 kg (80/40 mg).
Chez les patients toujours traités, les concentrations résiduelles moyennes (± ET) de l'adalimumab à la semaine 52 étaient de 9,5 ± 5,6 μg/ml dans le groupe traité à la dose standard et de 3,5 ± 2,2 μg/ml dans le groupe traité à la dose faible. Les concentrations résiduelles moyennes ont été maintenues chez les patients ayant continué à recevoir le traitement par adalimumab toutes les deux semaines pendant 52 semaines. Chez les patients dont le schéma posologique est passé de toutes les deux semaines à toutes les semaines, les concentrations sériques moyennes (± ET) de l'adalimumab à la semaine 52 étaient de 15,3 ± 11,4 μg/ml (40/20 mg, toutes les semaines) et de 6,7 ± 3,5 μg/ml (20/10 mg, toutes les semaines).
Chez les patients atteints de rectocolite hémorragique, la dose de charge de 160 mg d'adalimumab à la semaine 0 suivie de 80 mg d'adalimumab à la semaine 2 permet d'obtenir des concentrations sériques résiduelles d'adalimumab d'environ 12 μg/ml pendant la période d'induction. Des concentrations résiduelles moyennes à l'état d'équilibre d'environ 8 μg/ml ont été observées chez des patients atteints de rectocolite hémorragique ayant reçu une dose d'entretien de 40 mg d'adalimumab toutes les deux semaines.
Après administration sous-cutanée de la dose déterminée par le poids de 0,6 mg/kg (dose maximale de 40 mg) toutes les deux semaines chez des patients pédiatriques atteints de rectocolite hémorragique, la concentration sérique résiduelle moyenne de l'adalimumab à l'état d'équilibre était de 5,01 ± 3,28 μg/ml à la semaine 52. Chez les patients qui recevaient une dose de 0,6 mg/kg (dose maximale de 40 mg) chaque semaine, la concentration sérique résiduelle moyenne (± ET) de l'adalimumab à l'état d'équilibre était de 15,7 ± 5,60 μg/ml à la semaine 52.
Chez les patients adultes atteints d'uvéite, la dose de charge de 80 mg d'adalimumab à la semaine 0 suivie de 40 mg d'adalimumab toutes les deux semaines à partir de la semaine 1 a permis d'obtenir des concentrations moyennes d'adalimumab à l'état d'équilibre d'environ 8 à 10 μg/ml.
L'exposition à l'adalimumab chez les patients atteints d'uvéite pédiatrique a été prédite en utilisant une modélisation pharmacocinétique de population et une simulation basée sur la pharmacocinétique observée dans différentes indications pédiatriques (psoriasis pédiatrique, arthrite juvénile idiopathique, maladie de Crohn pédiatrique et arthrite liée à l'enthésite). Aucune donnée d'exposition clinique n'est disponible sur l'utilisation d'une dose de charge chez les enfants âgés de moins de 6 ans. Les expositions prévisibles indiquent qu'en l'absence de méthotrexate, une dose de charge peut entraîner une augmentation initiale de l'exposition systémique.
Une modélisation et une simulation pharmacocinétiques et pharmacocinétiques/pharmacodynamiques de population ont prédit une exposition et une efficacité comparables chez les patients traités par 80 mg toutes les deux semaines en comparaison avec 40 mg toutes les semaines (y compris les patients adultes atteints de PR, HS, RCH, MC ou Ps, les adolescents atteints d'HS, et les patients pédiatriques ≥ 40 kg atteints de MC et RCH).
Relation exposition-réponse dans la population pédiatrique
Sur la base des données des essais cliniques chez les patients atteints d'AJI (AJI polyarticulaire et arthrite liée à l'enthésite), une relation exposition-réponse a été démontrée entre les concentrations plasmatiques et la réponse ACR pédiatrique 50. La concentration plasmatique d'adalimumab apparente produisant la moitié de la probabilité maximale de réponse ACR pédiatrique 50 (CE50) était de 3 µg/ml (IC à 95 % : 1 - 6 μg/ml).
Des relations exposition-réponse entre la concentration d'adalimumab et l'efficacité chez les patients pédiatriques atteints de psoriasis en plaques sévère ont été établies pour les résultats PASI 75 et PGA « clair ou minimal », respectivement. Les taux de résultats PASI 75 et PGA « clair ou minimal » ont augmenté à mesure de l'augmentation des concentrations d'adalimumab, avec une CE50 apparente similaire d'environ 4,5 μg/ml (IC à 95 % respectifs de 0,4 - 47,6 et 1,9 - 10,5) dans les deux cas.
Élimination
Les analyses pharmacocinétiques de populations portant sur des données recueillies chez plus de 1 300 patients atteints de PR, ont révélé une tendance à une augmentation de la clairance apparente de l'adalimumab avec une augmentation du poids corporel. Après ajustement en fonction des différences pondérales, le sexe et l'âge ont semblé avoir peu d'effet sur la clairance de l'adalimumab. Il a été observé que les taux sériques d'adalimumab libre (non lié aux anticorps anti-adalimumab, AAA) étaient plus bas chez les patients dont les AAA étaient mesurables.
Insuffisance hépatique ou rénale
L'adalimumab n'a pas été étudié chez les patients présentant une insuffisance hépatique ou rénale.
L'adalimumab peut avoir une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines. Des vertiges et des troubles visuels peuvent survenir après l'administration d'Amsparity (voir rubrique Effets indésirables).
Les données non cliniques issues des études de toxicologie en administration unique, toxicologie en administration répétée et de génotoxicité, n'ont pas révélé de risque particulier pour l'homme.
Une étude de toxicité portant sur le développement embryo-fœtal et le développement périnatal a été réalisée chez des singes cynomolgus à 0, 30 et 100 mg/kg (9 - 17 singes/groupe) ; elle n'a pas révélé de signe de fœto-toxicité de l'adalimumab. Ni une étude du pouvoir carcinogène, ni une évaluation standard sur la fertilité et la toxicité post-natale n'ont été effectuées avec l'adalimumab en raison du manque de modèles appropriés pour un anticorps présentant une réactivité croisée limitée avec le TNF de rongeur et du développement d'anticorps neutralisants chez le rongeur.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I
Prescription réservée aux spécialistes et services en
DERMATOLOGIE
Prescription réservée aux spécialistes et services en
HEPATO/GASTRO-ENTEROLOGIE
Prescription réservée aux spécialistes et services
en MEDECINE INTERNE
Prescription réservée aux spécialistes et services en
OPHTALMOLOGIE
Prescription réservée aux spécialistes et services en
PEDIATRIE
Prescription réservée aux spécialistes et services en RHUMATOLOGIE
Médicament d'exception.
Remboursement en fonction de
l'indication (JO du 30/04/2021) :
Les seules indications
thérapeutiques ouvrant droit à la prise en charge par l'assurance maladie sont
:
- Polyarthrite rhumatoïde (adulte)
En association au méthotrexate, traitement de la polyarthrite rhumatoïde
modérément à sévèrement active de l'adulte lorsque la réponse aux traitements
de fond, y compris le méthotrexate, est inadéquate.
ASMPARITY peut être donné en monothérapie en cas d'intolérance au méthotrexate
ou lorsque la poursuite du traitement avec le méthotrexate est inadaptée.
Il a été montré qu'AMSPARITY ralentit la progression des dommages structuraux
articulaires mesurés par radiographie et améliore les capacités fonctionnelles
lorsqu'il est administré en association au méthotrexate.
- Spondyloarthrite axiale (adulte)
Spondylarthrite ankylosante (SA) :
Traitement de la spondylarthrite ankylosante sévère et active chez l'adulte
ayant eu une réponse inadéquate au traitement conventionnel.
Spondyloarthrite axiale sans signes radiographiques de SA :
Traitement de la spondyloarthrite axiale sévère sans signes radiographiques de
SA, mais avec des signes objectifs d'inflammation à l'IRM et/ou un taux élevé
de CRP chez les adultes ayant eu une réponse inadéquate ou une intolérance aux
anti-inflammatoires non stéroïdiens.
- Rhumatisme psoriasique (adulte)
Traitement du rhumatisme psoriasique actif et évolutif chez les adultes
lorsque la réponse à un traitement de fond antérieur a été inadéquate. Il a été
montré qu'AMSPARITY ralentit la progression des dommages structuraux
articulaires périphériques tels que mesurés par radiographie, chez les patients
ayant des formes polyarticulaires symétriques de la maladie et améliore les
capacités fonctionnelles.
- Arthrite juvénile idiopathique (enfant et adolescent)
Arthrite juvénile idiopathique polyarticulaire :
En association au méthotrexate : traitement de l'arthrite juvénile idiopathique
polyarticulaire évolutive chez les patients à partir de 2 ans en cas de réponse
insuffisante à un ou plusieurs traitements de fond.
AMSPARITY peut être administré en monothérapie en cas d'intolérance au
méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est
inadaptée. AMSPARITY n'a pas été étudié chez l'enfant de moins de 2 ans.
Arthrite liée à l'enthésite :
Traitement de l'arthrite active liée à l'enthésite chez les patients à partir
de 6 ans en cas de réponse insuffisante ou d'intolérance au traitement
conventionnel.
- Psoriasis en plaques (enfant, adolescent et l'adulte)
Traitement du psoriasis en plaques chronique sévère de l'enfant à partir de 4
ans, de l'adolescent et de l'adulte, défini par :
- un échec (réponse insuffisante, contre-indication ou intolérance) à au moins
deux traitements parmi les traitements systémiques non biologiques et la
photothérapie ;
- et une forme étendue et/ou un retentissement psychosocial important.
- Maladie de Crohn (adulte)
Traitement de la maladie de Crohn active modérée à sévère, chez les patients
adultes qui n'ont pas répondu malgré un traitement approprié et bien conduit
par un corticoïde et/ou un immunosuppresseur ; ou chez lesquels ce traitement
est contre-indiqué ou mal toléré.
- Maladie de Crohn (enfant et adolescent)
Traitement de la maladie de Crohn active, sévère, chez les enfants et les
adolescents âgés de 6 à 17 ans, qui n'ont pas répondu à un traitement
conventionnel comprenant un corticoïde, un immunomodulateur et un traitement
nutritionnel de première intention ; ou chez lesquels ces traitements sont mal
tolérés ou contre-indiqués.
- Rectocolite hémorragique (enfant, adolescent et adulte)
Traitement de la rectocolite hémorragique active, modérée à sévère chez les
patients qui n'ont pas répondu de manière adéquate à un traitement
conventionnel comprenant les corticoïdes et l'azathioprine ou la
6-mercaptopurine, ou chez lesquels ce traitement est mal toléré ou
contre-indiqué.
- Uvéite (adulte)
Traitement de l'uvéite non infectieuse, intermédiaire, postérieure et de la
panuvéite chez les patients adultes ayant eu une réponse insuffisante à la
corticothérapie, chez les patients nécessitant une épargne cortisonique, ou
chez lesquels la corticothérapie est inappropriée.
- Uvéite (enfant et adolescent)
En association au méthotrexate, traitement de l'uvéite antérieure chronique non
infectieuse associée à une arthrite juvénile idiopathique chez l'enfant à
partir de de 2 ans et l'adolescent, en cas de réponse insuffisante ou
d'intolérance au traitement conventionnel ou pour lesquels un traitement
conventionnel est inapproprié.
Solution injectable. (injection)
Solution limpide, incolore à brun très clair.
Amsparity 40 mg, solution injectable en seringue préremplie
Amsparity 40 mg, solution injectable en seringue préremplie à usage unique (verre de type I) munie d'un bouchon-piston (caoutchouc chlorobutyle) et d'une aiguille avec un capuchon protecteur (élastomère thermoplastique).
Boîte de :
- 2 seringues préremplies (0,8 ml de solution stérile) avec 2 tampons d'alcool, chaque seringue préremplie est sous plaquette.
Amsparity 40 mg, solution injectable en seringue préremplie
Une seringue préremplie unidose de 0,8 ml contient 40 mg d'adalimumab.
L'adalimumab est un anticorps monoclonal humain recombinant produit dans des cellules ovariennes de hamster chinois.
Excipients à effet notoire :
Amsparity 40 mg, solution injectable contient 0,16 mg de polysorbate 80 par seringue préremplie unidose et par stylo prérempli unidose de 0,8 ml, équivalant à 0,2 mg/ml de polysorbate 80.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
L-histidine
Chlorhydrate de L-histidine monohydraté
Saccharose
Édétate disodique dihydraté
L-méthionine
Polysorbate 80
Eau pour préparations injectables